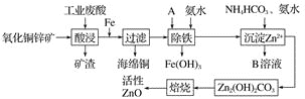
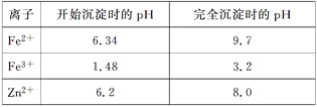
题目内容
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.质量为16g的O2和O3的混合气体中所含的氧原子的个数为NA
B.18 g NH4+含有质子数为10NA
C.1 mol过氧化钠与足量水反应时,转移电子的数目为2NA
D.0.1 molL﹣1的NaCl溶液中,Na+与Cl﹣的离子总数为0.2NA
【答案】A
【解析】
A、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=![]() =1mol,故为NA个,故A正确;
=1mol,故为NA个,故A正确;
B、18g铵根离子的物质的量为1mol,而1mol铵根离子含11mol质子,即11NA个,故B错误;
C、过氧化钠与水的反应为歧化反应,1mol过氧化钠与水反应转移1mol电子即NA个,故C错误;
D、溶液的体积未知,无法计算NaCl溶液中的离子总数,故D错误;
故选A。
【点晴】
本题考查阿伏加德罗常数的有关计算和判断,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力;解答该类试题时要注意:①气体的体积,一要看是否为标准状况下;二要看物质在标准状况下是否为气态,如CCl4、水、液溴、SO3、己烷、苯等常作为命题的干扰因素迷惑学生。②给出非标准状况下气体的物质的量或质量,干扰学生正确判断,误以为无法求解物质所含的粒子数。③熟悉常见物质的微观构成,弄清楚微粒中相关粒子数(质子数、中子数、电子数)及离子数、电荷数、化学键之间的关系。常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2等双原子分子,及O3、P4、18O2、D2O、Na2O2、CH4、CO2等特殊物质。

【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
【题目】下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为____________
(2)⑦的黄绿色单质的化学式为____________⑩的单质在常温下的存在状态为____________
(3)①的气态氢化物的水溶液显_______
(4)用电子式表示②与④形成化合物的过程______
(5)这些元素中的最高价氧化物对应的水化物中,碱性最强的是__呈两性的是__
(6)写出⑤与盐酸反应的化学方程式:__________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:______
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
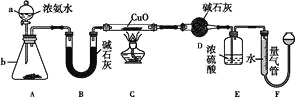
(1)仪器a的名称为____,仪器b中可选择的试剂为____。
(2)实验室中,利用装置A,还可制取的无色气体是____(填字母)。
A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式:_______________________。
(4)E装置中浓硫酸的作用是_____________________________________。
(5)读取气体体积前,应对装置F进行的操作:____________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____(用含m、n字母的代数式表示)。