题目内容
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
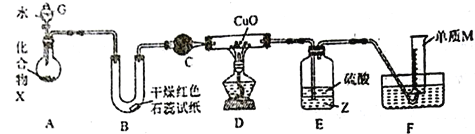
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中含组成单质M的元素质量分数为16.9%,写出X与水反应的化学方程式:_____________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D中固体颜色发生变化):__________________________________________________。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:__________________________________________________。
【答案】 分液漏斗 ![]() Na3N+3H2O=3NaOH+NH3↑ 碱石灰 黑色粉末逐渐变为红色,硬质玻璃管末端有水珠凝结 CC14 吸收未反应的NH3,并防止倒吸 称量反应前后硬质玻璃管内固体物质的质量 不可行,因为装置A中生成的氨气不可能完全与 CuO反应
Na3N+3H2O=3NaOH+NH3↑ 碱石灰 黑色粉末逐渐变为红色,硬质玻璃管末端有水珠凝结 CC14 吸收未反应的NH3,并防止倒吸 称量反应前后硬质玻璃管内固体物质的质量 不可行,因为装置A中生成的氨气不可能完全与 CuO反应
【解析】(1)仪器G的名称是分液漏斗;B中红色石蕊试纸变蓝,则产生氨气,氨气与氧化铜加热反应反应生成单质M为氮气,其电子式为![]() ;(2)化合物X中含氮元素质量分数为16.9%,X应该为氮与活泼金属形成的氮化物,则
;(2)化合物X中含氮元素质量分数为16.9%,X应该为氮与活泼金属形成的氮化物,则![]() ,
, ![]() ,则X为Na3N,Na3N与水反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑;(3)C中的试剂用于干燥氨气,名称为碱石灰;(4)实验时,装置D中硬质玻璃管内的现象为黑色粉末逐渐变为红色.硬质玻璃管末端有水珠凝结;(5)装置E中试剂Z为CCl4,装置E的作用是吸收未反应的NH3,并防止倒吸;(6)若不通过E、F两装置, 称量反应前后硬质玻璃管内固体物质的质量,通过固体质量的变化证明D中发生了反应(不通过观察D中固体颜色发生变化);(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,方案不可行, 因为装置A中生成的氨气不可能完全与CuO反应。
,则X为Na3N,Na3N与水反应的化学方程式为:Na3N+3H2O=3NaOH+NH3↑;(3)C中的试剂用于干燥氨气,名称为碱石灰;(4)实验时,装置D中硬质玻璃管内的现象为黑色粉末逐渐变为红色.硬质玻璃管末端有水珠凝结;(5)装置E中试剂Z为CCl4,装置E的作用是吸收未反应的NH3,并防止倒吸;(6)若不通过E、F两装置, 称量反应前后硬质玻璃管内固体物质的质量,通过固体质量的变化证明D中发生了反应(不通过观察D中固体颜色发生变化);(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,方案不可行, 因为装置A中生成的氨气不可能完全与CuO反应。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究,过程如下:
(1)调节pH,实验记录如下:
实验 | pH | 现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
I.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
II.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是____________________________。
②推测a中白色沉淀为Ag2SO4,推测的依据是_________________________________。
(2)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于_________溶液中,未溶解。
(3)将X从溶液中滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
II.向X中加入过量浓HNO3,产生红棕色气体
III.用Ba(NO3)2溶液、BaCl2溶液检验II中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是_________________________。
②根据上述现象,分析X的性质和元素组成是__________________________。
③II中反应的化学方程式是________________________。
(4)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,SO32-还原性增强,并通过进一步实验确认了这种可能性,实验装置如图所示:

①气体Y是__________________。
②白色沉淀转化为X的化学方程式是__________________________。

