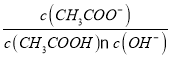题目内容
【题目】钛及其化合物的研究与应用越来越受到人们的重视。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,可由TiCl4和LiBH4反应制得。
①在基态Ti2+中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为____
②LiBH4由Li+和BH4-构成,BH4-的立体结构是____,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为_____。
③TiCl4在常温下是无色液体,则TiCl4属于_______(填“原子”“分子”或“离子”)晶体。
(2)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮(![]() )分子中含有π键与σ键数目之比为______。
)分子中含有π键与σ键数目之比为______。
②甲醛(![]() )分子中C原子轨道杂化类型为_______;
)分子中C原子轨道杂化类型为_______;
甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b._______。
(3)某种氮化钛晶体的晶胞如图所示,该晶体中与N原子距离相等且最近的N原子有__个,Ti原子的配位数为______;该晶胞中N、Ti原子之间的最近距离为a nm,则该氮化钛晶体的密度为_______g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

【答案】M 9 正四面体形 H>B>Li 分子 1∶9 sp2杂化 甲醛与水分子之间能形成氢键 12 6 ![]()
【解析】
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d2;
②BH4-中B原子的价层电子对数为4,孤电子对数为0;非金属性越强,电负性越大,金属性越强,电负性越小;
(2)①丙酮分子中含有碳氧双键,1个丙酮分子中含有6个碳氢σ键,2个碳碳σ键,1个碳氧σ键,共有9个σ键,1个碳氧π键;
②甲醛分子中含有碳氧双键;甲醛分子与水分子之间可以形成氢键;
(3)以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置;以体心的Ti原子研究,其周围有6个N原子;依据均摊法计算。
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为1s22s22p63s23p63d2,由电子排布式可知,电子占据的最高能层符号为M,该能层具有的原子轨道数为(1+3+5)=9,故答案为:M;9;
②BH4-中B原子的价层电子对数为4,孤电子对数为0,则BH4-的空间构型为正四面体形;非金属性越强,电负性越大,金属性越强,电负性越小,Li为金属元素,非金属性H元素大于B元素,则电负性强弱顺序为H>B>Li,故答案为:正四面体;H>B>Li;
③TiCl4在常温下是无色液体,说明沸点低,属于分子晶体,故答案为:分子晶体;
(2)①丙酮分子中含有碳氧双键,1个丙酮分子中含有6个碳氢σ键,2个碳碳σ键,1个碳氧σ键,共有9个σ键,1个碳氧π键,则分子中含有π键与σ键数目之比为1:9,故答案为:1:9;
②甲醛分子中含有碳氧双键,则碳原子轨道的杂化类型为sp2杂化;甲醛分子与水分子之间可以形成氢键,氢键的存在能够大大增强物质的溶解性,故答案为:甲醛与水分子之间形成氢键;
(3)以晶胞顶点N原子研究,与之距离相等且最近的N原子处于面心位置,每个顶点为8个晶胞共用,每个面为2个晶胞共用,故与之距离相等且最近的N原子为![]() =12;以体心的Ti原子研究,其周围有6个N原子,配位数为6,;根据均摊法,可知该晶胞中N原子个数为:6×
=12;以体心的Ti原子研究,其周围有6个N原子,配位数为6,;根据均摊法,可知该晶胞中N原子个数为:6×![]() +8×
+8×![]() =4,该晶胞中Ti原子个数为:1+12×
=4,该晶胞中Ti原子个数为:1+12×![]() =4,晶胞的质量为
=4,晶胞的质量为![]() mol×62g/mol=(2a×10-7)3cm3×ρ,ρ=
mol×62g/mol=(2a×10-7)3cm3×ρ,ρ=![]() g/cm3。
g/cm3。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案