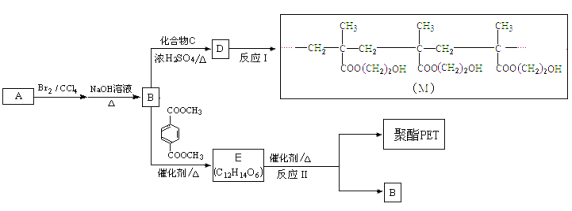
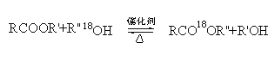题目内容
【题目】热激活电池可用作火箭.导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb。

下列有关说法正确的是
A .正极反应式:Ca+2Cl- - 2e- =CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针不偏转
D.每转移0.1mol电子,理论上生成20.7g Pb
【答案】C
【解析】
试题分析:A.正极发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,故A错误;B.放电过程中阳离子向正极移动,故B错误;C.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故C正确;D.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可知每转移0.1 mol电子,理论上生成0.05molPb,质量为10.35g,故D错误;故选C。

练习册系列答案
相关题目