题目内容
已知NH4+ + OH-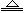 NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Na+、K+、Cl- |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)="0.01" mol/L,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
D
解析试题分析:取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成,说明白色沉淀为BaCO3和BaSO4,则溶液中含有CO32-、SO42-;向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,说明溶液中有NH4+;另取上述原溶液少量,滴加用硝酸酸化的硝酸银溶液,没有明显现象,说明溶液中没有Cl-.故溶液中一定存在SO42-、CO32-、NH4+,一定不存在Cl-,可能存在Na+、K+。沉淀4.30g为BaCO3和BaSO4的总量,又向沉淀中加入过量的盐酸,有2.33g沉淀不溶,故BaSO4的物质的量为(2.33g)/(233g/mol)="0.01mol," 则BaCO3的的物质的量为0.01 mol,c(CO32-)="0.01mol/0.2L=0.05" mol/L,又NH4+ + OH-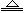 NH3↑ + H2O,且NH3的物质的量为1.12L/(22.4L/mol)=0.05mol。则c(NH4+)>c(SO42-)。如果上述6种离子都存在,则存在如下平衡:n(Na+)+ n(K+)+ n(NH4+)= n(SO42-) +n (CO32-) +n (Cl-),即n(Na+)+ n(K+)+0.05mol=0.01mol+0.01mol+ n (Cl-),故n (Cl-)=0.03+ n(Na+)+ n(K+)﹥n(SO42-)即c(Cl-)>c(SO42-)。
NH3↑ + H2O,且NH3的物质的量为1.12L/(22.4L/mol)=0.05mol。则c(NH4+)>c(SO42-)。如果上述6种离子都存在,则存在如下平衡:n(Na+)+ n(K+)+ n(NH4+)= n(SO42-) +n (CO32-) +n (Cl-),即n(Na+)+ n(K+)+0.05mol=0.01mol+0.01mol+ n (Cl-),故n (Cl-)=0.03+ n(Na+)+ n(K+)﹥n(SO42-)即c(Cl-)>c(SO42-)。
考点:常见阳离子的检验;常见阴离子的检验。

 习题精选系列答案
习题精选系列答案下列各组离子在给定条件下,能大量共存的是( )
| A.含有NO3–的水溶液中:NH4+、Fe2+、SO 42– 、H+ |
| B.含有CO32–的澄清透明溶液中:K+、C6H5O–、Cl–、Na+ |
| C.在pH=2的溶液中:ClO–、SO32–、Na+ 、K+ |
| D.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COO–、I– |
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无
色。则下列关于溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
| A.①③ | B.①②③ | C.③④ | D.②③④ |
下列离子方程式正确的是( )
| A.碳酸氢钠溶液与盐酸反应:CO32- + 2H+ = CO2↑+ H2O |
| B.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| C.少量的NaHSO4与过量Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O |
| D.碳酸钙溶于过量稀盐酸中:CaCO3+2H+= Ca2++H2O+CO2↑ |
下列反应中属于氧化还原反应的离子方程式的是
| A.CaCO3+2H+=Ca2++CO2↑+H2O | B.2Fe2++Cl2=2Fe3++2Cl- |
| C.HCO3-+H+=CO2+H2O | D.Na2O+H2O=2Na++2OH- |
在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、CO32-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有 ( )
| A.4种 | B.5种 | C.6种 | D.7种 |
下列叙述正确的是
| A.NaCl溶液在电流作用下电离成Na+与Cl- |
| B.溶于水后能电离出H+ 的化合物都是酸 |
| C.氯化氢溶于水能导电,但液态氯化氢不能导电 |
| D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
以下离子方程式书写错误的是( )
①铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
②硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
③碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
④氢氧化铜中加入盐酸:OH-+H+=H2O
| A.①②④ | B.①③ | C.全部 | D.①④ |
下列离子方程式不正确的是
| A.将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B.将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C.向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D.向稀硝酸中加人铜片:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |