题目内容
下列叙述正确的是
| A.NaCl溶液在电流作用下电离成Na+与Cl- |
| B.溶于水后能电离出H+ 的化合物都是酸 |
| C.氯化氢溶于水能导电,但液态氯化氢不能导电 |
| D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
C
解析试题分析:A、氯化钠溶于水在水分子的作用下电离出阴阳离子,而不是在电流的作用下发生电离,A不正确;B、溶于水后能电离出的阳离子全部是H+ 的化合物是酸,B不正确;C、氯化氢溶于水能导电,氯化氢是电解质。但液态氯化氢不能电离,因此不能导电,C正确;D、溶液的导电性强弱只与溶液中离子的浓度和离子所带电荷数有关系,离子浓度越大,所带电荷数越多,导电性越强。所以导电性强的溶液里自由移动离子数目不一定比导电性弱的溶液里自由移动离子数目多,D不正确,答案选C。
考点:考查电解质电离、酸的判断、溶液导电以及溶液导电性强弱比较

练习册系列答案
相关题目
下列物质能导电,且属于电解质的是
| A.二氧化硫的水溶液 | B.熔融态氯化钠 | C.铜 | D.冰醋酸 |
下列叙述正确的是( )
| A.液态HCl不导电,所以HCl是非电解质 |
| B.NH3的水溶液能够导电,所以NH3是电解质 |
| C.液态Cl2不导电,所以Cl2是非电解质 |
| D.BaSO4在熔融状态下能导电,所以BaSO4是电解质 |
已知NH4+ + OH-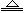 NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Na+、K+、Cl- |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)="0.01" mol/L,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
在下列给定条件的溶液中,一定能大量共存的离子组是
| A.无色溶液:Ca2+、H+、Cl-、HSO3- |
| B.能使pH试纸呈红色的溶液:Na+、Fe2+、Cl-、NO3- |
| C.Na2CO3溶液:K+、Fe3+、NO3-、NO3- |
D.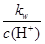 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
下列反应的离子方程式正确的是
| A.澄清石灰水跟盐酸反应:OH-+H+=H2O |
| B.金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| C.碳酸钡与醋酸反应:BaCO3+2H+=CO2↑+Ba2++H2O |
| D.碳酸氢钠溶液和氢氧化钠溶液反应:HCO3-+OH-=CO2↑+H2O |
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有
| A.滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl–、I– |
| B.水电离出来的c(H+)=10-13mol·L–1的溶液:K+、HCO3–、Br–、Ba2+ |
| C.在c(H+)=10-13 mol·L–1的溶液:K+、SO42–、Al3+、Cl– |
| D.PH=1的溶液:Cu2+、Na+、Mg2+、NO3– |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A.氯化钠晶体、硫酸钡 | B.铜、二氧化硫 |
| C.硫酸、酒精 | D.熔融的硝酸钾、硫酸钠溶液 |
下列表示对应化学反应的离子方程式正确的是
| A.向氯化铝溶液通入过量的氨气:Al3++4OH-=AlO2-+2H2O |
B.MnO2与浓盐酸反应制Cl2: MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| C.FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+=Cu2++2Fe2+ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |