题目内容
以下离子方程式书写错误的是( )
①铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
②硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
③碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
④氢氧化铜中加入盐酸:OH-+H+=H2O
| A.①②④ | B.①③ | C.全部 | D.①④ |
C。
解析试题分析:①应生成Fe2+,②还应该生成Cu(OH)2沉淀,③Ca(HCO3)2是易溶、易电离的强电解质,应拆开,④Cu(OH)2是难溶物,不能拆开。所以所有的两种方程式都错误。选项为:C.
考点:考查离子方程式书写应该注意的问题。

下列物质属于电解质的一组是
| A.CO2、NH3、HCl | B.H2SO4、HNO3、BaCl2 |
| C.H2SO4、H2O、Cu | D.液态KNO3、NaOH溶液、CH3CH2OH |
已知NH4+ + OH-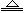 NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
NH3↑ + H2O,NH3能使湿润的红色石蕊试纸变蓝。现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-。为确认溶液组成进行如下实验:(1)取200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Na+、K+、Cl- |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)="0.01" mol/L,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
下列反应的离子方程式正确的是
| A.澄清石灰水跟盐酸反应:OH-+H+=H2O |
| B.金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| C.碳酸钡与醋酸反应:BaCO3+2H+=CO2↑+Ba2++H2O |
| D.碳酸氢钠溶液和氢氧化钠溶液反应:HCO3-+OH-=CO2↑+H2O |
在给定的四种溶液中,加入以下各种离子后,各离子能在原溶液中大量共存的有
| A.滴加酚酞试液显红色的溶液:Fe2+、NH4+、Cl–、I– |
| B.水电离出来的c(H+)=10-13mol·L–1的溶液:K+、HCO3–、Br–、Ba2+ |
| C.在c(H+)=10-13 mol·L–1的溶液:K+、SO42–、Al3+、Cl– |
| D.PH=1的溶液:Cu2+、Na+、Mg2+、NO3– |
下列电离方程式中,正确的是
| A.Na2CO3=Na++CO32- | B.Ba(OH)2=Ba2++OH2- |
| C.H2SO4=H2++SO42- | D.NaCl=Na++Cl- |
下列各组物质,前者属于电解质,后者属于非电解质的是( )
| A.氯化钠晶体、硫酸钡 | B.铜、二氧化硫 |
| C.硫酸、酒精 | D.熔融的硝酸钾、硫酸钠溶液 |
列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A.Na+、H+、CO32-、Cl- | B.H+、Fe2+、Cl-、NO3- |
| C.Na+、Al3+、OH-、Cl- | D.NH4+、H+、OH-、NO3- |
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2-、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失.下列判断正确的是( )
| A.一定不含Fe3+和Fe2+ |
| B.一定含有Fe3+ ,但一定不含Fe2+ |
| C.溶液可能含有NO3- |
| D.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有 |