题目内容
5.研究性学习的本质在于,让学生亲历知识产生与形成的过程.我校某化学研究性学习小组欲以CO2为主要原料,采用如图1所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.【资料获悉】“侯氏制碱法”原理:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,然后再将NaHCO3灼烧制成Na2CO3.

【实验设计】如图1所示
【实验探究】
(1)装置乙的作用是除去CO2中的HCl.
(2)若在NaHCO3灼烧中时间较短,NaHCO3将分解不完全.取经短暂加热的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图22所示.则曲线b对应的溶液中的离子是CO32-(填离子符号);该样品中Na2CO3和NaHCO3的物质的量之比是3:1.
(3)若将装置甲产生的纯净的CO21.68L(标准状况下)缓慢地全部通入到100mL NaOH溶液中,充分反应后,将溶液低温蒸干,得到不含结晶水的固体W,其质量为7.4g,则W的成分为Na2CO3和NaHCO3(填化学式),原NaOH溶液的物质的量浓度为1.25mol/L.
分析 (1)装置甲是制备二氧化碳,气体中含有氯化氢气体对后续实验产生干扰,需要除去;
(2)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多;
(3)根据CO2与NaOH的反应所得产物的可能性来讨论.
解答 解:(1)装置甲是制备二氧化碳气体的反应装置,生成的二氧化碳气体中含有氯化氢气体,对制备碳酸氢钠有影响,装置乙的作用是吸收氯化氢气体,
故答案为:除去CO2中的HCl;
(2)碳酸氢钠灼烧的时间较短,NaHCO3将分解不完全,取加热后的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入会发生反应 CO32-+H+=HCO3-、HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以b曲线表示的是CO32-浓度变化,碳酸根离子浓度0.3mol;碳酸氢根离子浓度为0.1mol,样品中Na2CO3和NaHCO3物质的量之比是3:1,
故答案为:CO32-;3:1;
(3)标准状况下1.68L二氧化碳的物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,CO2与NaOH溶液反应时,根据NaOH是否过量分情况讨论:
若NaOH过量或恰好完全反应,0.075molCO2与NaOH反应后生成0.075molNa2CO3,Na2CO3的质量为:m=nM=0.075mol×106g/mol=7.95g>7.4g,故假设不成立;说明NaOH不过量,即所得的固体中为Na2CO3或NaHCO3或两者的混合物,
设所得的固体中Na2CO3的物质的量为xmol,NaHCO3的物质的量为ymol,
根据碳元素的守恒可有:x+y=0.075mol①
根据所得固体的质量为7.4g可得:106x+84y=7.4g②
解得:x=0.05mol、y=0.025mol,
根据所得固体中Na2CO3为0.05mol,NaHCO3为0.025mol,根据钠元素的守恒可知,NaOH的物质的量n=0.05mol×2+0.025mol×2=0.125mol,
故NaOH的物质的量浓度c=$\frac{0.125mol}{0.1L}$=1.25mol/L,
故答案为:Na2CO3和NaHCO3; 1.25 mol/L.
点评 本题考查了工业制纯碱的原理及其应用,题目难度中等,明确实验目的及实验原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算、化学实验能力.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案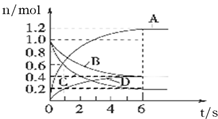 一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体,发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断不合理的是( )| A. | 该反应的化学方程式为3B+4C═6A+2D | |
| B. | 反应进行到1s时,v(A)和v(D)不相等 | |
| C. | 反应开始到6s,B的平均反应速率为0.1mol•L-1•s-1 | |
| D. | 反应进行到6s时,各物质的浓度不再变化,达到平衡状态 |
| A. | Ba(OH)2溶液滴入稀硫酸中 | B. | 氢氧化钠溶液和稀硝酸反应 | ||
| C. | 氢氧化镁和稀盐酸反应 | D. | NaOH溶液滴入醋酸中 |
| A. | 4Fe(OH)2+2H2O+O2═4Fe(OH)3 | B. | 2Fe+2H2O+O2═2Fe(OH)2 | ||
| C. | 负极反应:Fe-3e-═Fe3+ | D. | 正极反应:2H2O+O2+4e--═4OH- |
| A. | 从CH4、NH4+、SO42-为正四面体结构,可推测PH4-、PO43-也为正四面体结构 | |
| B. | 1 mol金刚石晶体中,平均含有2 mol C-C键 | |
| C. | HF、HCl、HBr、HI的热稳定性从左到右依次减弱 | |
| D. | 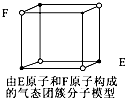 某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
| A. | 不可能是离子晶体 | B. | 不可能是单质分子构成的晶体 | ||
| C. | 可能是分子晶体 | D. | 可能具有较高的熔沸点 |
| A. | NaOH溶液中混有Ba(OH)2 (K2SO4溶液) | B. | O2中混有H2(灼热的氧化铜) | ||
| C. | CO2中混有HCl气体 (NaOH溶液) | D. | Cu粉中混有Al粉(稀盐酸) |
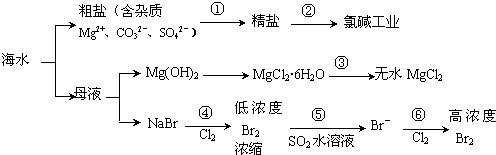
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| C. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| A | B | C | D | |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 | 增加O2浓度对反应平衡的影响 | 浓度对平衡常数的影响 |
| 图示 |  | 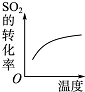 |  |  |
| A. | A | B. | B | C. | C | D. | D |