��Ŀ����
��19�֣�̼���仯�����й㷺����;��
��1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��
C(s)�� H2O(g) CO(g) ��H2(g) ��H=" +131.3" kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ�ӿ췴Ӧ���������������H2O��ƽ��ת���ʵ��� ��(�����)
CO(g) ��H2(g) ��H=" +131.3" kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ�ӿ췴Ӧ���������������H2O��ƽ��ת���ʵ��� ��(�����)
��2����֪��C��s��+ CO2��g�� 2CO��g�� ��H=+172.5kJ?mol-1
2CO��g�� ��H=+172.5kJ?mol-1
д��C��s����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽ ��
��3���״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���KOH��Һ���������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ�� ��
���øõ���ṩ�ĵ��ܵ��600mLNaCl��Һ������0.01molCH3OH��ȫ�ŵ磬NaCl�������ҵ�������Cl2ȫ����������ǰ�������Һ����ı仯�����������������Һ��pH=
��4����һ������CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2.0L�ĺ����ܱ������У��������·�Ӧ��
CO(g)��H2O(g) CO2(g)��H2(g)���õ��������ݣ�
CO2(g)��H2(g)���õ��������ݣ�
ͨ����������÷�Ӧ��ƽ�ⳣ��(���������λ��Ч����)����������������������
�ı䷴Ӧ��ijһ��������Ӧ���е�tminʱ����û��������CO2�����ʵ���Ϊ0.6 mol������200 mL 4.5 mol/L��NaOH��Һ������ȫ���գ���Ӧ�����ӷ���ʽΪ����һ�����ӷ���ʽ��ʾ��������������
��5����ҵ�����ǰ�ˮú���еĻ�����徭���������õĽϴ�H2���ںϳɰ����ϳɰ���Ӧԭ��Ϊ��N2(g)+3H2(g) 2NH3(g) ��H��-92.4kJ?mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��
2NH3(g) ��H��-92.4kJ?mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��
��ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ1��
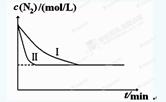

ͼ1 ͼ2
��ش��������⣺
����ʵ���Ƚϣ�ʵ���ı������Ϊ ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��1����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��
C(s)�� H2O(g)
 CO(g) ��H2(g) ��H=" +131.3" kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ�ӿ췴Ӧ���������������H2O��ƽ��ת���ʵ��� ��(�����)
CO(g) ��H2(g) ��H=" +131.3" kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ�ӿ췴Ӧ���������������H2O��ƽ��ת���ʵ��� ��(�����)| A�������¶ȡ� | B������̼������ | C��������� | D����CO���ռ���ȥCO E.����ѹǿ |
 2CO��g�� ��H=+172.5kJ?mol-1
2CO��g�� ��H=+172.5kJ?mol-1д��C��s����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽ ��
��3���״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���KOH��Һ���������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ�� ��
���øõ���ṩ�ĵ��ܵ��600mLNaCl��Һ������0.01molCH3OH��ȫ�ŵ磬NaCl�������ҵ�������Cl2ȫ����������ǰ�������Һ����ı仯�����������������Һ��pH=
��4����һ������CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2.0L�ĺ����ܱ������У��������·�Ӧ��
CO(g)��H2O(g)
 CO2(g)��H2(g)���õ��������ݣ�
CO2(g)��H2(g)���õ��������ݣ�| �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ����x��ʱ��/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
�ı䷴Ӧ��ijһ��������Ӧ���е�tminʱ����û��������CO2�����ʵ���Ϊ0.6 mol������200 mL 4.5 mol/L��NaOH��Һ������ȫ���գ���Ӧ�����ӷ���ʽΪ����һ�����ӷ���ʽ��ʾ��������������
��5����ҵ�����ǰ�ˮú���еĻ�����徭���������õĽϴ�H2���ںϳɰ����ϳɰ���Ӧԭ��Ϊ��N2(g)+3H2(g)
 2NH3(g) ��H��-92.4kJ?mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��
2NH3(g) ��H��-92.4kJ?mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ����ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ1��


ͼ1 ͼ2
��ش��������⣺
����ʵ���Ƚϣ�ʵ���ı������Ϊ ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��1��A ��2�֣�
��2��C(s)+2H2O(g)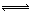 CO2(g)+2H2(g) ?H="90.1" kJ?mol-1��3�֣�
CO2(g)+2H2(g) ?H="90.1" kJ?mol-1��3�֣�
��3��CH3OH(g) +8OH?-6e-=CO32? +6H2O ��3�֣� 13��2�֣�
��4��K=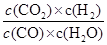 =
= =0.17 ��3�֣�
=0.17 ��3�֣�
2CO2 +3OH- ===CO32- + HCO3- + H2O ��3�֣�
��5����ʹ�ô�����1�֣���
�� ��2�֣������������Դ���0����Ȣ��1�֣��Ȣ���1�֣�
��2�֣������������Դ���0����Ȣ��1�֣��Ȣ���1�֣�
��2��C(s)+2H2O(g)
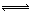 CO2(g)+2H2(g) ?H="90.1" kJ?mol-1��3�֣�
CO2(g)+2H2(g) ?H="90.1" kJ?mol-1��3�֣���3��CH3OH(g) +8OH?-6e-=CO32? +6H2O ��3�֣� 13��2�֣�
��4��K=
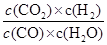 =
= =0.17 ��3�֣�
=0.17 ��3�֣�2CO2 +3OH- ===CO32- + HCO3- + H2O ��3�֣�
��5����ʹ�ô�����1�֣���
��
 ��2�֣������������Դ���0����Ȣ��1�֣��Ȣ���1�֣�
��2�֣������������Դ���0����Ȣ��1�֣��Ȣ���1�֣������������1��A�������¶ȣ���ѧ��Ӧ���ʼӿ죬����ӦΪ���ȷ�Ӧ��ƽ��������Ӧ�����ƶ������H2O��ƽ��ת���ʣ���ȷ��B��̼Ϊ���壬����̼��������Ӧ���ʺ�ƽ�ⶼ���䣬����C�����������ƽ�ⲻ�ƶ�������D����CO���ռ���ȥCO�����H2O��ƽ��ת���ʣ�����Ӧ���ʼ�С������E������ѹǿ��ƽ�����淴Ӧ�����ƶ���H2O��ƽ��ת���ʼ�С������
��2������д��C��s����H2O��g����Ӧ����CO2��g����H2��g���Ļ�ѧ����ʽ��ע��״̬��C(s)+2H2O(g)
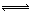 CO2(g)+2H2(g)��Ȼ����ݸ�˹�������ʱ䣬?H=2?H1��?H2="2��131.3" kJ?mol-1��172.5kJ?mol-1="90.1" kJ?mol-1���ɵ��Ȼ�ѧ����ʽ��
CO2(g)+2H2(g)��Ȼ����ݸ�˹�������ʱ䣬?H=2?H1��?H2="2��131.3" kJ?mol-1��172.5kJ?mol-1="90.1" kJ?mol-1���ɵ��Ȼ�ѧ����ʽ����3���״��ڵ�ظ�����ʧȥ���ӣ�KOH��Һ���������Һ������CO32?��H2O����ƽ�ɵõ�ⷽ��ʽ��CH3OH(g) +8OH?-6e-=CO32? +6H2O����غ͵���ͨ���ĵ�����ȣ����ݵ缫����ʽ�͵���ת�ƿɵã�CH3OH ~ 6e? ~ 6OH?����n��OH?��=6n��CH3OH��=0.06mol����c��OH?��=0.06mol��0.6L=0.1mol?L?1���ɵ�pH=13��
��4����������ʽ���м��㣺
H2O (g) + CO(g)
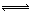 H2(g) + CO2(g)
H2(g) + CO2(g) ��ʼŨ�ȣ�mol?L?1�� 0.5 1 0 0
ת��Ũ�ȣ�mol?L?1�� 0.2 0.2 0.2 0.2
ƽ��Ũ�ȣ�mol?L?1�� 0.3 0.8 0.2 0.2
K=
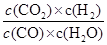 =
= =0.17
=0.17��CO2��NaOH�����ʵ���֮��Ϊ1:1������NaHCO3����CO2��NaOH�����ʵ���֮��Ϊ1:2������Na2CO3����Ŀ����CO2���ʵ���Ϊ0.6mol��NaOH�����ʵ���Ϊ��0.2L��4.5mol?L?1=0.9mol���������ʵ���֮��Ϊ2:3������CO32?��HCO3?����ƽ�ɵ����ӷ���ʽ��2CO2 +3OH- ===CO32- + HCO3- + H2O
��5������ͼ���֪ʵ���Ӧ���ʼӿ죬����ѧƽ��û���ƶ�������ʵ���ı������Ϊʹ���˴�����ʵ����ʵ�����¶�Ҫ�ߣ���Ӧ���ʼӿ죬��Ϊ�÷�ӦΪ���ȷ�Ӧ����������ƽ�����淴Ӧ�����ƶ���ƽ��ʱNH3��ƽ��Ũ�ȼ�С���ɻ���ͼ��

��ϰ��ϵ�д�
 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
�����Ŀ

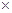 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6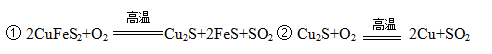

 NH3��H2O
NH3��H2O 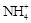 + OH��
+ OH�� Cu2+ + SO42- �� H2��
Cu2+ + SO42- �� H2��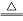 Mn2++2Cl-+Cl2��+2H2O
Mn2++2Cl-+Cl2��+2H2O Al(OH)3��+3H+
Al(OH)3��+3H+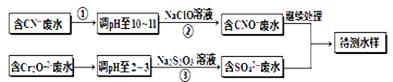
 (��������,�������ֱ�ʾԪ�ؼ�̬)�ij���������1mol Cr2O72-�������a mol FeSO4?7H2O�����н�����ȷ���� ��
(��������,�������ֱ�ʾԪ�ؼ�̬)�ij���������1mol Cr2O72-�������a mol FeSO4?7H2O�����н�����ȷ���� ��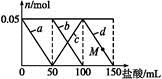
 +H++H2O
+H++H2O Al(OH)3��
Al(OH)3�� ��
�� NH3��H2O��H��
NH3��H2O��H��