题目内容
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:
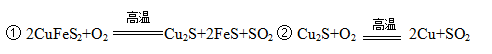
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。

① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
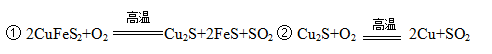
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。

① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
(1)-2
(2)Cu2S
(3)①SiO2+2OH-=SiO32-+H2O Al2O3+2OH-=2AlO2-+H2O
②4FeO+O2+12H+=4Fe3++6H2O 再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。
(2)Cu2S
(3)①SiO2+2OH-=SiO32-+H2O Al2O3+2OH-=2AlO2-+H2O
②4FeO+O2+12H+=4Fe3++6H2O 再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。
(1)二硫化亚铁铜也可以表示为CuS。FeS,其中硫元素的化合价是-2价;
(2)反应②中Cu2S中Cu元素的化合价由+1价升高到+2价,硫元素的化合价由-2价升高到+4价,被氧化,做还原剂;
(3)①炉渣中加入过量氢氧化钠溶液发生的离子方程式是SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;②滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是,4FeO+O2+12H+=4Fe3++6H2O;为检验铁元素是否被完全氧化,可难舍难分滤液中是否含有Fe2+,应进行的实验操作是,取少量滤液2于试管中,再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。
(2)反应②中Cu2S中Cu元素的化合价由+1价升高到+2价,硫元素的化合价由-2价升高到+4价,被氧化,做还原剂;
(3)①炉渣中加入过量氢氧化钠溶液发生的离子方程式是SiO2+2OH-=SiO32-+H2O,Al2O3+2OH-=2AlO2-+H2O;②滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是,4FeO+O2+12H+=4Fe3++6H2O;为检验铁元素是否被完全氧化,可难舍难分滤液中是否含有Fe2+,应进行的实验操作是,取少量滤液2于试管中,再滴入2-3滴酸性高锰酸钾溶液,若紫色褪色,则氧化不完全,反之氧化完全。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
 )既有氧化性又有还原性
)既有氧化性又有还原性 NH3↑+H2O
NH3↑+H2O Na2CO3+ CO2↑+H2O
Na2CO3+ CO2↑+H2O
 CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施加快反应速率且有利于提高H2O的平衡转化率的是 。(填序号) CO2(g)+H2(g),得到如下数据:
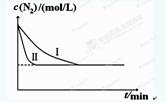
CO2(g)+H2(g),得到如下数据: 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。