题目内容
已知:H2(g)+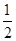 O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1 ③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1 ④
下列说法正确的是
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+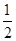 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
C
解析试题分析:A.②③④是物质状态的变化,没有新物质生成,是物理变化。错误。B.物质由液态转变为气态需要吸收热量,因此1 mol液态H2的能量小于1 mol气态H2的能量。错误。C. 燃烧热是1mol的物质完全燃烧产生稳定的化合物时所放出的热量。液态的水是稳定状态。因此正确。D.①-②×1/2-③-④,整理可得:H2(l)+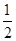 O2(l)=H2O(g) ΔH=-237.46kJ·mol-1.错误。
O2(l)=H2O(g) ΔH=-237.46kJ·mol-1.错误。
考点:考查盖斯定律的应用、热化学方程式的书写的知识。

练习册系列答案
相关题目
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)与 O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是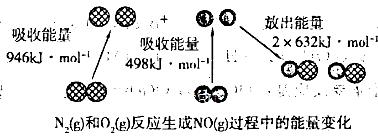
| A.1 mol N2(g)和1 molO2 (g)具有的总能量大于 2 mol NO(g)具有的总能量 |
| B.1 molN2 (g)和l molO2 (g)反应生成2 mol NO(g)吸收180 kJ热量. |
| C.通常情况下N2(g)和O2(g)混合能直接反应生成NO |
| D.数据不足,不能确定反应热的大小 |
下列与化学反应能量变化相关的叙述正确的是
| A.生成物总能量一定低于反应物总能量 |
| B.拆开物质中的化学键一定需要吸收能量 |
| C.应用盖斯定律,无法计算某些难以直接测量的反应焓变 |
| D.化学反应都伴随着能量变化和其他各种现象的出现 |
下列有关化学反应与能量的说法正确的是
| A.酸碱中和是放热反应 |
| B.炭在二氧化碳气体中灼烧发生的反应属于放热反应 |
| C.原子间形成化学键时需吸收能量 |
| D.化学反应过程中,化学能一定全部转化成热能 |
下列说法或表示方法中,正确的是
| A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多 |
| B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1 |
| C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1 |
| D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 |
下列关于化学反应与能量的说法正确的是
| A.铵盐与碱的反应一般为放热反应 |
| B.化学反应一定既伴随着物质变化又伴随着能量变化 |
| C.反应物断旧键所吸收的能量高于生成物形成新键所放出的能量的反应为放热反应 |
| D.反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |
下列说法正确的是
| A.CO能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| B.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| C.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量 |
| D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中加热△H ="-57.3" kJ/mol,则H2SO4和Ca(OH) 2反应的 中和热△H =2×(-57.3)kJ/mol |
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) 2CO(g)+O2(g)反应 2CO(g)+O2(g)反应的△H =" +2×283.0" kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
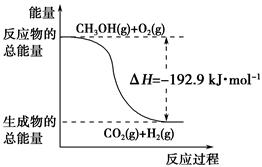
已知:①CH3OH (g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+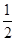 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+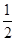 O2(g)===CO2(g)+2H2(g)的 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②中的能量变化如下图所示 |