题目内容
下列说法或表示方法中,正确的是
| A.等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多 |
| B.a ℃、b kPa下,将0.5 mol O2和1.5 mol H2置于密闭容器中充分反应生成H2O(g),放热c kJ,其热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-2c kJ·mol-1 |
| C.常温常压下,2.8 g CO气体完全燃烧放出的热量为28.26 kJ,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·mol-1 |
| D.稀硫酸溶液与稀NaOH溶液反应的中和热为57.3 kJ·mol-1,则稀醋酸溶液与稀NaOH溶液反应的热化学方程式可表示为CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 |
A
解析试题分析:A、由于硫蒸汽的能量高于硫固体的能量,所以等质量的硫蒸气和硫黄分别完全燃烧,前者放出的热量多,A正确;B、反应中氢气过量,消耗氢气是1mol,生成水是1mol,但由于反应条件是a ℃、b kPa下,所以该反应的热化学方程式为2H2(g)+O2(g)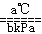 2H2O(g) ΔH=-2c kJ·mol-1,B不正确;C、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示CO燃烧热的热化学方程式为CO(g)+
2H2O(g) ΔH=-2c kJ·mol-1,B不正确;C、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示CO燃烧热的热化学方程式为CO(g)+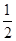 O2(g)=CO2(g) ΔH=-282.6kJ·mol-1,C不正确;D、由于醋酸是弱酸存在电离平衡,而电离是吸热的,所以醋酸与氢氧化钠溶液反应生成1mol水时发出的热量小于57.3kJ,D不正确,答案选A。
O2(g)=CO2(g) ΔH=-282.6kJ·mol-1,C不正确;D、由于醋酸是弱酸存在电离平衡,而电离是吸热的,所以醋酸与氢氧化钠溶液反应生成1mol水时发出的热量小于57.3kJ,D不正确,答案选A。
考点:考查反应热以及热化学方程式的正误判断

下列做法不能体现低碳生活的是
| A.减少食物加工过程 | B.注意节约用电 |
| C.尽量购买本地的、当季的食物 | D.大量使用薪柴为燃料 |
已知:H2(g)+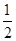 O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1 ③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1 ④
下列说法正确的是
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+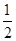 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
下列各图有关量的变化趋势中错误的是
A B C D
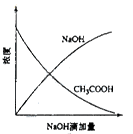
| A.图A为向盐酸中滴加NaOH发生中和反应过程中溶液温度的变化趋势 |
| B.图B为向醋酸中滴加NaOH发生中和反应过程中各物质浓度的变化趋势 |
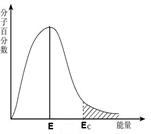
| C.图C中能量≥Ec的分子称为活化分子,E为分子平均能量,则活化能为Ec-E |
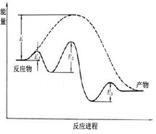
| D.图D为未加入催化剂和加入催化剂的反应进程中的能量变化 |
下列说法正确的是
| A.同温同压下,H2 (g)+Cl2(g)= 2HCl(g)在光照和点燃条件下的△H相同 |
| B.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| C.已知:①2H2(g) +O2(g) =2H2O(g) △H="-a" kJ·mol-1,②2H2(g)+O2 (g)= 2H2O(1)△H="-b" kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2 (g)=CO2(g)△H="-" 393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2 (g)△H="-" 395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石)△H=" -1.5" kJ·mol-1 |
下列有关热化学方程式的叙述中,正确的是
| A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(1) ΔH=+57.4kJ/mo1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH =—483.6kJ/mol,则H2燃烧热为241.8kJ/mol |
| D.己知2C(s)+2O2(g)=2CO2(g) ΔH 1;2C(s)+O2(g)="2CO(g)" ΔH 2;则ΔH 1<ΔH 2 |
知:① 2C(已s)+O2(g) =2CO(g)  H= -221.0kJ/mmol
H= -221.0kJ/mmol
②2H2(g) + O2(g) =2H2O(g)  H= -483.6kJ/ol。
H= -483.6kJ/ol。
则制备水煤气的反应 C(s) +H2O(g) = CO(g) + H2(g)的 H为
H为
| A.+262.6kJ/mol | B.-131.3kJ/mol | C.-352.3kJ/mol | D.+131.3kJ/mol |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )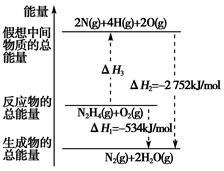
| A.194 | B.391 | C.516 | D.658 |
已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol①
Fe2O3(s)+ CO(g)=
CO(g)=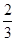 Fe3O4(s)+
Fe3O4(s)+ CO2(g) ΔH=-15.73 kJ/mol②
CO2(g) ΔH=-15.73 kJ/mol②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol③
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
| A.-218 kJ/mol | B.-109 kJ/mol |
| C.+218 kJ/mol | D.+109 kJ/mol |