题目内容
下列变化中,属于还原反应的是
| A.Cl-→Cl2 | B.FeCl2→FeCl3 | C.C→CO2 | D.KMnO4→MnO2 |
D
解析试题分析:在变化中物质如果发生还原反应,则应该得到电子,由反应前到反应后,元素的化合价降低。A.Cl-→Cl2,化合价升高。错误。B.FeCl2→FeCl3 化合价升高,错误。C.C→CO2化合价升高,错误。D.KMnO4→MnO2Mn的化合价降低,符合要求。正确。
考点:考查氧化还原反应中化合价的升降与化学反应的关系。

 高中必刷题系列答案
高中必刷题系列答案有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂和还原剂的物质的量之比为1∶8 |
| B.该过程说明Fe(NO3)2溶液不宜加酸酸化 |
| C.每1 mol NO3-发生氧化反应,转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是:①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl- ③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
| A.FeCl2 | B.KMnO4 | C.浓盐酸 | D.FeCl3 |
金属钾的冶炼可采用如下方法:2KF+CaC2 CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
| A.该反应的氧化剂是KF,氧化产物是K |
| B.该反应能说明C的还原性大于K |
| C.电解KF溶液不可能制备金属钾 |
| D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1 |
已知X和Y是两种单质,X+Y→X2++Y2-,现有下列叙述正确的是: ①X被氧化,②X是氧化剂,③Y2-是还原产物,④X2+具有氧化性,⑤Y2-具有还原性,⑥Y单质氧化性比X2+氧化性强( )
| A.①②③ | B.①②⑥ | C.①③④⑤⑥ | D.①③④⑤ |
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O— MnO4- + SO42- H+
对上述两个反应判断正确的是:
| A.①②反应中SO42—都是氧化产物 |
| B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 |
| D.氧化性:MnO4—> S2O82— |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物
共0.9mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的
盐溶液,其中NaNO3的物质的量为( )
| A.0.2mol | B.0.4mol | C.0.8mol | D.0.9mol |
在100mL含等物质的量的HI和H2SO3的溶液里通入0.14molCl2,有三分之一的HI变为I2(已知:I2+H2SO3+H2O=4H++SO42—+2I—)。原溶液中HI和H2SO3的浓度都等于
| A.8.0 mol?L-1 | B.0.12 mol?L-1 |
| C.0. 8 mol?L-1 | D.1.2 mol?L-1 |
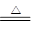 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。