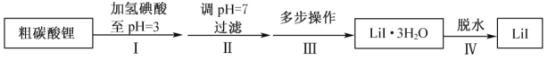
题目内容
【题目】离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
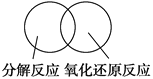
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系_________________。

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式_________________________在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
【答案】③⑤ 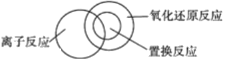 Ba2++HCO3-+H++SO42-=BaSO4
Ba2++HCO3-+H++SO42-=BaSO4![]() +CO2
+CO2![]() +H2O、 HCO3-+H+= CO2
+H2O、 HCO3-+H+= CO2![]() +H2O
+H2O
【解析】
(1)离子反应为有离子参加或离子生成的化学反应;
(2)部分离子反应是氧化还原反应,且属于置换反应;而置换反应全部为氧化还原反应;
(3)向碳酸氢钡溶液中滴加硫酸氢钠溶液至完全沉淀时,只消耗一个碳酸氢根离子生成硫酸钡沉淀、二氧化碳气体和水;继续滴加则为氢离子与碳酸氢根离子反应生成二氧化碳和水;
(1)离子反应为有离子参加或离子生成的化学反应,则反应物或生成物中一定含有电解质或化合物,答案为③⑤;
(2)部分离子反应是氧化还原反应,且属于置换反应;而置换反应全部为氧化还原反应,则三者之间的关系为: ;
;
(3)向碳酸氢钡溶液中滴加硫酸氢钠溶液至完全沉淀时,只消耗一个碳酸氢根离子生成硫酸钡沉淀、二氧化碳气体和水,反应的离子方程式为:Ba2++HCO3-+H++SO42-=BaSO4![]() +CO2
+CO2![]() +H2O,继续滴加则为氢离子与碳酸氢根离子反应生成二氧化碳和水,离子方程式为:HCO3-+H+= CO2
+H2O,继续滴加则为氢离子与碳酸氢根离子反应生成二氧化碳和水,离子方程式为:HCO3-+H+= CO2![]() +H2O;
+H2O;

 特高级教师点拨系列答案
特高级教师点拨系列答案