题目内容
6.3.01×1024个H2O的物质的量是5mol,质量是90g,体积是90mL;与5mol CH4 含有相同的分子数,与2.5mol CH4 含有相同的氢原子数.分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算,注意水的密度为1g/mL,以此解答.
解答 解:n(H2O)=$\frac{3.01×1{0}^{24}}{6.02×1{0}^{23}/mol}$=5mol,m(H2O)=5mol×18g/mol=90g,水的密度为1g/mL,则体积为90mL,含有10molH;
与 5mol CH4 含有相同的分子数,与2.5mol CH4 含有相同的氢原子数.
故答案为:5mol;90g;90mL;5;2.5.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算,有利于基础知识的巩固.

练习册系列答案
相关题目
17.已知王水由盐酸和硝酸组成,c(Cl-)+c(NO3-)=18mol•L-1.为了测定王水的组成,取100mL该王水加水稀释至250mL,取25mL稀溶液加入足量的硝酸银溶液,过滤、洗涤、烘干、称重,得固体质量mg.则该王水中硝酸的物质的量浓度(mol•L-1)为( )
| A. | $\frac{10m}{143.5}$ | B. | $\frac{100m}{143.5}$ | C. | 18-$\frac{100m}{143.5}$ | D. | 18-$\frac{10m}{143.5}$ |
14.N的质量数为14,在微粒[NH3T]中,电子数、质子数、中子数之比为( )
| A. | 10:7:11 | B. | 10:11:9 | C. | 10:11:8 | D. | 11:9:10 |
15.含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中Cl-为1.5mol,K+为1.0mol,Na+为0.5mol,Mg2+为0.5mol,则SO42-的物质的量为( )
| A. | 0.15 mol | B. | 0.25 mol | C. | 0.5 mol | D. | 1 mol |
2.单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.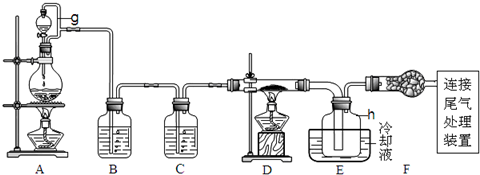
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集.
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+.
①写出用KMnO4滴定Fe2+的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前是否要滴加指示剂?否(填“是”或“否”),判断滴定终点的方法是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色.
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响偏低(填“偏高”、“偏低”、或“无影响”)

查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)装置A中g管的作用是平衡压强,使液体顺利流出并防止漏气;装置C中的试剂是浓硫酸;装置E中的h瓶需要冷却理由是产物SiCl4沸点低,需要冷凝收集.
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+.
①写出用KMnO4滴定Fe2+的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前是否要滴加指示剂?否(填“是”或“否”),判断滴定终点的方法是当滴入最后一滴KMnO4溶液时,溶液颜色由无色变为紫色,且30秒不褪色.
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是4.480%.若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响偏低(填“偏高”、“偏低”、或“无影响”)
 ②
② ③
③ ④
④ ⑤
⑤