题目内容
【题目】如图所示,在常温下,将铁棒和石墨棒插入盛有足量饱和NaCl溶液的U型管中,下列分析正确的是( )
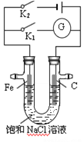
A. K1闭合,Na+向铁棒移动
B. K1闭合,碳棒上发生的反应为2H++2e—=H2↑
C. K2闭合,电路中通过0.2NA个电子时,石墨电极上生成2.24L标况下气体
D. K2闭合,铁棒不易被腐蚀,电路中通过0.001NA个电子时,摇匀后溶液的pH为11
【答案】C
【解析】K1闭合形成原电池,Fe为负极,石墨棒为正极,原电池内部阳离子应该向正极移动,所以Na+向碳棒移动,选项A错误。铁碳原电池,氯化钠为电解质时,发生吸氧腐蚀,正极反应应该是氧气得电子,选项B错误。K2闭合,形成电解池,Fe为阴极,电解氯化钠溶液的阳极反应为2Cl- - 2e- = Cl2↑,所以电路中通过0.2NA个电子时,石墨电极上生成0.1mol(标况下为2.24L)气体,选项C正确。题目中一直没有说明溶液的体积,所以一定无法计算pH,选项D错误。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】NOx是大气污染物之一,主要来源于工业烟气及汽车尾气等。除去NOx的方法统称为脱硝,一般有干法脱硝[选择性催化剂法(SCR)]、湿法脱硝等。
请完成下列问题:
(1)汽车发动机工作时会引发反应N2(g)+O2(g)![]() 2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。
2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。

(2)在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO 的转化率随时间变化关系如图2 所示。
①反应2NO(g)![]() N2(g)+O2(g) △H_______0 (填“>”或“<” )。
N2(g)+O2(g) △H_______0 (填“>”或“<” )。
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
C.NO、N2、O2 的浓度保持不变 d.2v(NO)正=v(N2 )逆
(3)干法脱硝:SCR(选择性催化剂法)技术可有效降低柴油发动机在空气过量条件下的NO 排放。其工作原理如下:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为____________。
②反应器中NH3 还原NO 的化学方程式为____________________。
(4)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_______________________。