题目内容
【题目】NOx是大气污染物之一,主要来源于工业烟气及汽车尾气等。除去NOx的方法统称为脱硝,一般有干法脱硝[选择性催化剂法(SCR)]、湿法脱硝等。
请完成下列问题:
(1)汽车发动机工作时会引发反应N2(g)+O2(g)![]() 2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。
2NO(g)。2000 K 时,向固定容积的密闭容器中充入等物质的量的N2、O2 发生上述反应,各组分体积分数(φ)的变化如图1所示。N2 的平衡转化率为_____________。
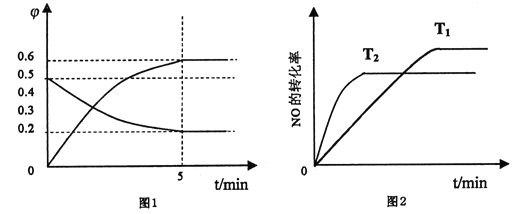
(2)在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO 的转化率随时间变化关系如图2 所示。
①反应2NO(g)![]() N2(g)+O2(g) △H_______0 (填“>”或“<” )。
N2(g)+O2(g) △H_______0 (填“>”或“<” )。
②一定温度下,能够说明反应2NO(g)![]() N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
N2(g)+O2(g)已达到化学平衡的________(填序号)。a.容器内的压强不发生变化 b.混合气体的密度不发生变化
C.NO、N2、O2 的浓度保持不变 d.2v(NO)正=v(N2 )逆
(3)干法脱硝:SCR(选择性催化剂法)技术可有效降低柴油发动机在空气过量条件下的NO 排放。其工作原理如下:
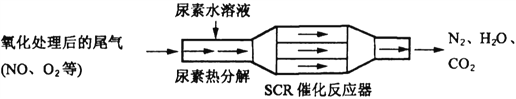
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式为____________。
②反应器中NH3 还原NO 的化学方程式为____________________。
(4)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_______________________。
【答案】 60% < c CO(NH2)2+H2O![]() 2NH3↑+CO2↑ 4NH3+6NO
2NH3↑+CO2↑ 4NH3+6NO![]() 5N2+6H2O ClO2-+H2O
5N2+6H2O ClO2-+H2O![]() HClO2+OH- 12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O
HClO2+OH- 12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O
【解析】(1)起始时N2、O2的浓度相等,设为amol/L,平衡时NO体积分数为0.6,N2体积分数为0.2,由三段式求解:
N2(g)+O2(g)![]() 2NO(g)
2NO(g)
起始(mol) a a 0
转化(mol) 0.6a 0.6a 1.2a
平衡(mol) 0.4a 0.4a 1.2a
N2的平衡转化率==0.6amol÷amol==60%。
(2) ①T2先于T1达到平衡,说明T2>T1,温度高时NO的转化率低,说明正反应是放热反应,△H<0;②因反应前后气体的物质的量不变,则容器内的压强不发生变化不能判断反应是否达到平衡,a错误;因反应前后体系内气体质量不变,容积不变,密度就不变,故混合气体的密度不发生变化不能判断反应是否达到平衡,b错误;C.NO、N2、O2 的浓度保持不变,c正确;(NO)正/ v(N2)逆=2,说明正、逆速率相等,达到平衡,d错误,故答案选c。
(3)(1)①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,结合原子守恒,发生反应的化学方程式为CO(NH2)2+H2O![]() 2NH3↑+CO2↑;②从图中可以看出NH3在催化剂作用下还原NO生成氮气和水,根据电子守恒和原子守恒可得此反应的化学方程式为4NH3+6NO
2NH3↑+CO2↑;②从图中可以看出NH3在催化剂作用下还原NO生成氮气和水,根据电子守恒和原子守恒可得此反应的化学方程式为4NH3+6NO![]() 5N2+6H2O 。
5N2+6H2O 。
(4) ①NaClO2 是强碱弱酸盐,在水溶液中水解显碱性,离子方程式为:ClO2-+H2O![]() HClO2+OH-;②由表格中数据分析可知,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,硝酸根离子与亚硝酸根离子物质的量之比为2:1,则总反应的离子方程式为: 12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O。
HClO2+OH-;②由表格中数据分析可知,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,硝酸根离子与亚硝酸根离子物质的量之比为2:1,则总反应的离子方程式为: 12NO+7ClO2-+12OH-=8NO3-+4NO2-+7Cl-+6H2O。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)2SO3(g)△H<0.得到如表中的两组数据:
实验编号 | 温度/℃ | 平衡常数/mol﹣1L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
① | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
② | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法不正确的是( )
A.x=1.6,y=0.2,t<6
B.T1、T2的关系:T1>T2
C.K1、K2的关系:K2>K1
D.实验1在前6 min的反应速率v (SO2)=0.2 molL﹣1min﹣1