题目内容
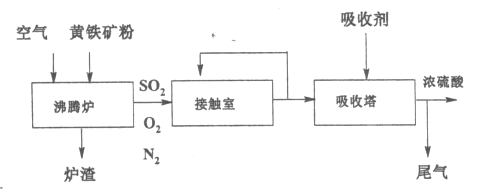
【题目】工业生产硫酸的流程如下图所示。己知黄铁矿的主要成分是FeS2(二硫化亚铁)。
请回答下列问题:
(1)FeS2中铁元素的化合价是_____________。
(2)接触室中生成SO3的化学方程式是_____________________。
(3)从接触室中出来并被循环利用的物质是______________________。
(4)工业上采用氨水处理尾气中的SO2,请写出足量氨水和SO2反应的离子方程式____________________________________________。
【答案】 +2 2SO2+O2 2SO3 SO2、O2 2NH3·H2O+SO2=2NH4++SO32-+H2O
2SO3 SO2、O2 2NH3·H2O+SO2=2NH4++SO32-+H2O
【解析】(1)硫元素化合价为-1价,根据化合价法则可求出FeS2中铁元素的化合价。
(2)接触室中二氧化硫被氧化为SO3。
(3)接触室中发生的反应为2SO2+O2 2SO3 ,所以SO2、O2 均有剩余,可以被循环利用。
2SO3 ,所以SO2、O2 均有剩余,可以被循环利用。
(4)氨水足量,与SO2反应生成亚硫酸铵。
(1)根据化合价法则,FeS2中硫元素为-1价,所以铁元素的化合价是+2价;正确答案:+2。
(2)接触室中,在催化剂条件下,二氧化硫被氧化为SO3,反应的化学方程式是2SO2+O2 2SO3; 正确答案:2SO2+O2
2SO3; 正确答案:2SO2+O2 2SO3 。
2SO3 。
(3)接触室中发生的反应为2SO2+O2 2SO3 ,所以SO2、O2 均有剩余,可以被循环利用;正确答案:SO2、O2。
2SO3 ,所以SO2、O2 均有剩余,可以被循环利用;正确答案:SO2、O2。
(4)足量氨水和SO2反应生成亚硫酸铵和水,反应的离子方程式:2NH3·H2O+SO2=2NH4++SO32-+H2O;正确答案:2NH3·H2O+SO2=2NH4++SO32-+H2O。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ. 向铝灰中加入过量稀H2SO4,过滤;
Ⅱ. 向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ. 加入MnSO4至紫红色消失,过滤;
Ⅴ. 加热浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是__________________。
(2)KMnO4氧化Fe2+的离子方程式补充完整:_________________
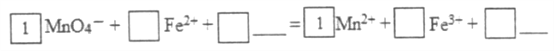
(3)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的_______________;
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________。
②Ⅳ中加入MnSO4的目的是_____________________。