题目内容
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
| A.②④ | B.② | C.①② | D.③④ |
A
解析试题分析:因为该反应是放热反应,反应达到平衡后,升高温度平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故①错误;因为该反应是放热反应,反应达到平衡后,升高温度平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故②正确;若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故③错误;在④图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,NO2的含量增大,故④正确,因此答案选A。
考点:考查化学反应限度及平衡移动原理及其应用

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案一定条件下反应2AB(g)  A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是
| A.单位时间内生成n mol A2,同时生成2n molAB |
| B.单位时间内生成n mol B2,同时生成2n molAB |
| C.AB的消耗速率等于A2的消耗速率 |
| D.容器中各组分的物质的量分数不随时间变化 |
在恒容密闭容器进行的可逆反应:MgSO4(s) + CO(g)  MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
MgO(s) + CO2(g) + SO2(g)-Q,下列分析合理的是
| A.若平衡常数K值变大,平衡移动时v逆先减小后增大 |
| B.容器中固体物质的质量不再改变,则反应到达平衡状态 |
| C.若x表示温度,y可表示平衡时混合气体的密度 |
| D.若x表示CO物质的量,y可表示平衡时CO2与CO物质的量之比 |
在一定体积的密闭容器中放入3 L气体R和5 L气体Q,在一定条件下发生反应:2R(g)+5Q(g) 4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
4X(g)+nY(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
| A.2 | B.3 | C.4 | D.5 |
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
| A.pH=1和pH=2的盐酸,c(H+)之比为1∶2 |
| B.物质A三态间的转化如下:A (g)→A (l)→A (s),则该转化过程中△S<0 |
| C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 |
| D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同 |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)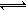 2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) ?H=?196kJ·moL?1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | | 0.4 |
| 15 | 0.8 | |
A.反应在前5min的平均速率为v (SO2)=0.08mol·L?1 min?1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
在1000K时,已知反应Ni(s)+H2O(g) NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应
NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应
| A.已达平衡状态 | B.未达平衡状态,反应正向进行 |
| C.未达平衡状态,反应逆向进行 | D.无法确定 |
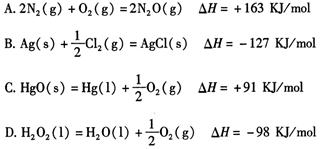
 2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )
2C(g)+2D(g)测得的用不同物质表示的反应速率,其中表示该化学反应的反应速率最快的是( )