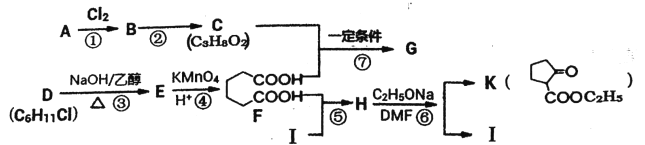
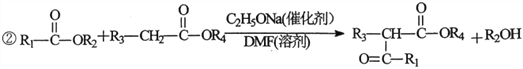
题目内容
【题目】用方铅矿(主要为PbS)和软锰矿(主要为MnO2,还有少量Al2O3等杂质)制备PbSO4和Mn3O4的工艺流程:

已知:(1)PbS+MnO2 +4H+=Mn2++Pb2++S+2H2O
(2)PbCl2(s)+2Cl-(aq)=PbCl42-(aq) △H>0
(1)80℃用盐酸处理两种矿石,为加快酸浸速率,还可采用的方法是_______________(任写一种)。
(2)向酸浸液中加入饱和食盐水的目的是________________________________;加入物质X可用于调节酸浸液的pH值,物质X可以是_______________
A.MnCO3 B.NaOH C.ZnO D.PbO
(3)滤渣中含有金属杂质形成的化合物,其成分为________________(写化学式)。
(4)向滤液2中通入NH3和O2发生反应,写出总反应的离子方程式:___________________
【答案】粉碎矿石、搅拌、适当增加盐酸浓度等 增大PbCl2的溶解度 AD Al(OH)3 ![]()
【解析】
方铅矿精矿(主要成分PbS)和软锰矿(主要成分MnO2,含有Al2O3等杂质)中加入稀盐酸并加热至80℃,发生的反应有:MnO2+PbS+4HCl=MnCl2+PbCl2+S+2H2O、Al2O3+6HCl=2AlCl3+3H2O,向酸浸溶液中加入NaCl溶液、X,调节溶液的pH,使Al3+转化为沉淀,要除去Al3+需要加入能与H+反应且不能引进新的杂质,然后过滤得到氢氧化铝沉淀和滤液,将滤液1分离得到PbCl2晶体和滤液2,向滤液2中通入氨气、氧气,锰离子被氧化生成Mn3O4,过滤得到Mn3O4和滤液,以此解答。
(1)采取粉碎矿石或搅拌或适当增加盐酸浓度等措施均能加快酸浸速率;
(2)由反应![]() 可知,向酸浸液中加入饱和食盐水,通过增大Cl浓度可促进PbCl2的溶解;加入物质X调节溶液的pH,使Al3+转化为沉淀,同时不引入新的杂质,结合滤液1中含有Mn2+和Pb2+,可选择MnCO3和PbO调节溶液pH,而NaOH和ZnO调节pH时会引进杂质离子,即答案选AD;
可知,向酸浸液中加入饱和食盐水,通过增大Cl浓度可促进PbCl2的溶解;加入物质X调节溶液的pH,使Al3+转化为沉淀,同时不引入新的杂质,结合滤液1中含有Mn2+和Pb2+,可选择MnCO3和PbO调节溶液pH,而NaOH和ZnO调节pH时会引进杂质离子,即答案选AD;
(3)酸浸液中加入MnCO3或PbO调节溶液pH,促进溶液中Al3+完全转化为Al(OH)3沉淀,滤渣中含有金属杂质形成的化合物,其成分为Al(OH)3;
(4)滤液2中含有Mn2+,通入NH3和O2生成Mn3O4,Mn元素化合价从+2价升高至![]() 价,O2中O元素化合价从0价降低至-2价,根据化合价升降守恒、电荷守恒以及原子守恒可知发生反应的离子方程式为:
价,O2中O元素化合价从0价降低至-2价,根据化合价升降守恒、电荷守恒以及原子守恒可知发生反应的离子方程式为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案