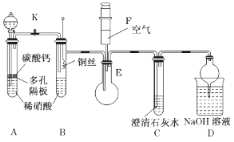
题目内容
【题目】一定温度下,AgCl(s)![]() Ag+(aq)+Cl-(Aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是( )
Ag+(aq)+Cl-(Aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法正确的是( )
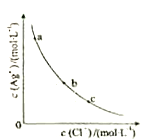
A. a、b、c三点对应的Ksp相等
B. AgCl在c点的溶解度比b点的大
C. AgCl溶于水形成的饱和溶液中,c(Ag+)=c(Cl-)
D. b点的溶液中加入AgNO3固体,c(Ag+)沿曲线向c点方向变化
【答案】AC
【解析】
A.溶度积常数只与温度有关;
B.AgCl在溶液中存在沉淀溶解平衡,向溶液中加入与AgCl电离产生的相同离子时,根据沉淀溶解平衡的影响因素分析移动方向,判断物质溶解度大小;
C.根据AgCl在溶液中的沉淀溶解平衡电离产生的Ag+、Cl-的关系判断离子浓度大小;
D.向AgCl饱和溶液中加入AgNO3固体,溶液中c(Ag+)会增大。
A.a、b、c三点对应的AgCl的沉淀溶解平衡所处的温度相同,而溶度积常数Ksp只与温度有关,温度相同,则Ksp相等,A正确;
B. 在AgCl溶于水形成的饱和溶液中c(Ag+)=c(Cl-),在AgCl(s)![]() Ag+(aq)+Cl-(Aq)平衡体系中c(Ag+)·c(Cl-)=Ksp(AgCl),若溶液中c(Cl-)大,则溶液中c(Ag+)小,AgCl的溶解度小,在b点溶液中c(Cl-)小于c点,则溶解度b点大于c点,B错误;
Ag+(aq)+Cl-(Aq)平衡体系中c(Ag+)·c(Cl-)=Ksp(AgCl),若溶液中c(Cl-)大,则溶液中c(Ag+)小,AgCl的溶解度小,在b点溶液中c(Cl-)小于c点,则溶解度b点大于c点,B错误;
C.根据溶解平衡AgCl(s)![]() Ag+(aq)+Cl-(aq)可知,在AgCl溶于水形成的饱和溶液中,溶解的AgCl电离产生的Cl-、Ag+的浓度相等,c(Ag+)=c(Cl-),C正确;
Ag+(aq)+Cl-(aq)可知,在AgCl溶于水形成的饱和溶液中,溶解的AgCl电离产生的Cl-、Ag+的浓度相等,c(Ag+)=c(Cl-),C正确;
D.在b点的溶液中加入AgNO3固体,溶液中c(Ag+)增大,则c(Cl-)减小,所以c(Ag+)变化应该是沿曲线向a点方向变化,D错误;
故合理选项是AC。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目