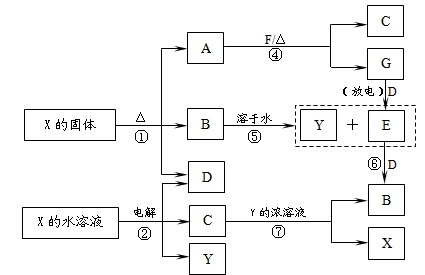
题目内容
某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO。
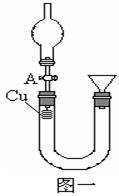
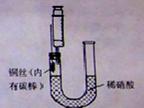
(1)补充完成下列实验步骤:
①__________________________________________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止;
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有_____色气体产生,溶液呈______色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为________________________________。
(3)试管内装有NO,倒置于水槽中,当向试管内通入21mLO2时,最后试管中的液面仍在原来的位置,则原试管中NO的体积为_________mL。
(4)0.1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量_______g。若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入2 mol·L-1的氢氧化钠溶液 _mL。

(1)补充完成下列实验步骤:
①__________________________________________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止;
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有_____色气体产生,溶液呈______色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为________________________________。
(3)试管内装有NO,倒置于水槽中,当向试管内通入21mLO2时,最后试管中的液面仍在原来的位置,则原试管中NO的体积为_________mL。
(4)0.1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量_______g。若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入2 mol·L-1的氢氧化钠溶液 _mL。
(1)检查装置气密性(2分)
(2)无 ,蓝 (各1分) 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(3)12mL(2分)
(4)0.96g(2分)40mL(2分)
(2)无 ,蓝 (各1分) 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(3)12mL(2分)
(4)0.96g(2分)40mL(2分)
试题分析:向装有NO的试管中通入O2,发生如下反应4NO+3O2+2H2O=4HNO3,假设NO的体积为x则消耗的O2为3x/4,4:3=x:3x/4解得x=12;混合酸中加入足量铜粉发生如下反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,溶液中H+的总量为0.09mol、NO3-的物质的量为0.01,假设Cu的物质的量为x,根据方程式则3:2=x:0.01,解得x=0.015,计算铜的质量为0.96g。且消耗的H+的物质的量为0.04mol,当加入氢氧化钠时先中和掉剩余的H+,需要氢氧化钠的量为0.05mol,将Cu2+全部转化为沉淀,需要氢氧化钠的量为0.03mol,则总共为0.08mol,据体积V=n/C,解得V="0.04L."

练习册系列答案
相关题目
 N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。