题目内容
【题目】25 ℃时,将1.0 L w mol·L-1的CH3COOH溶液与0.1 mol的NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体。溶液pH随通(加)入HCl或NaOH的物质的量的变化如下图。下列叙述正确的是 ( )
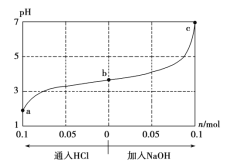
A.a、b、c对应的混合液中,水的电离程度由大到小的顺序是a>b>c
B.若忽略体积变化,则25 ℃时,CH3COOH的电离平衡常数K=![]() ×10-7 mol·L-1
×10-7 mol·L-1
C.加入NaOH过程中,![]() 逐渐减小
逐渐减小
D.加入NaOH过程中,c(Na+)·c(CH3COO-)逐渐减小
【答案】B
【解析】
A项,a、b对应的混合液显酸性,溶液中的![]() 主要来源于酸的电离,酸电离产生的
主要来源于酸的电离,酸电离产生的![]() 浓度越高,水的电离越抑制的程度越大;c对应的溶液呈中性,所以电离程度大小顺序应为:a<b<c,故A项错误;
浓度越高,水的电离越抑制的程度越大;c对应的溶液呈中性,所以电离程度大小顺序应为:a<b<c,故A项错误;
B项,分析图像最右端的c点,在此处![]() 为7,c(H+)=
为7,c(H+)=![]() 。已加入的
。已加入的![]() 物质的量为
物质的量为![]() ,溶液的体积为1L。溶液中原有的
,溶液的体积为1L。溶液中原有的![]() 物质的量为w mol,写出此时的电荷守恒式:
物质的量为w mol,写出此时的电荷守恒式:![]() ,又因为溶液呈中性,所以可以得
,又因为溶液呈中性,所以可以得![]() ,
,![]() ,所以
,所以![]() ,故B项正确;
,故B项正确;
C项,加入![]() 过程中,可知
过程中,可知![]() 的浓度和
的浓度和![]() 、
、![]() 的浓度均增大,
的浓度均增大,![]() 浓度减小,根据溶液电荷守恒
浓度减小,根据溶液电荷守恒![]() ,可知钠离子浓度增加大于醋酸根浓度增加,所以
,可知钠离子浓度增加大于醋酸根浓度增加,所以![]() 一定是增大的,故C项错误;
一定是增大的,故C项错误;
D项,加入![]() 过程中,可知
过程中,可知![]() 的浓度和
的浓度和![]() 、
、![]() 的浓度均增大,所以c(Na+)·c(CH3COO-)逐渐增大,故D项错误;
的浓度均增大,所以c(Na+)·c(CH3COO-)逐渐增大,故D项错误;
故答案选B。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目