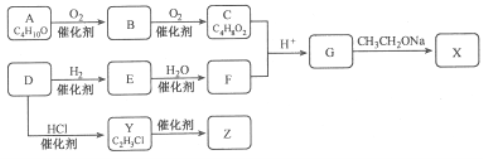
题目内容
【题目】已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.2 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 1.1 mol·L-1
【答案】A
【解析】已知:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为 ![]() =0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有
=0.15mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,碘离子完全氧化后,溶液中有 ![]() 的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为n(Cl2)=
的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+,设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c,c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为n(Cl2)= ![]() n(I-)=
n(I-)= ![]() cV=0.1cmol,反应完成后溶液中有
cV=0.1cmol,反应完成后溶液中有![]() 的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=
的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)= ![]() ×
× ![]() n(Fe2+)=
n(Fe2+)= ![]() cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol,解得:c=1.2mol/L,答案选A。
cV=0.025cmol,所以0.025cmol+0.1cmol=0.15mol,解得:c=1.2mol/L,答案选A。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目