题目内容
【题目】某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24 L,该混合体通入足量的溴水中,溴水增重1.4 g。
(1)该混合烃的平均摩尔质量为________;其中一定含有________(写名称)。
(2)通过简计算,确定另一种烃的分子组成:_________。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)任意写两种________。
【答案】26 g/mol 甲烷 C4H8 CH2=CH—CH2CH3、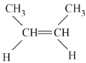 、
、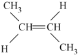 、
、![]() 中任意两种
中任意两种
【解析】
M(混合)=13×2 g/mol=26 g/mol,烯烃的摩尔质量最小为28 g/mol,则烷烃的摩尔质量应小于26 g/mol,摩尔质量小于26 g/mol的只有CH4,所以混合气体中一定含有甲烷,溴水增重1.4 g为烯烃的质量,可计算出甲烷的质量,进而计算烯烃的物质的量,再计算烯烃的摩尔质量,结合烯烃的组成通式确定烯烃分子式,由单烯烃的同分异构体可能有碳链异构、位置异构、顺反异构分析判断。
(1) M(混合)=13×2 g/mol=26 g/mol,烯烃的摩尔质量最小为28 g/mol,则烷烃的摩尔质量应小于26 g/mol,由于烷烃摩尔质量最小的是甲烷,为16 g/mol,乙烷为30 g/mol,所以混合气体中一定含有甲烷;
(2)2.24 L标准状况下的混合气体的物质的量n(混合)=![]() =0.1 mol,混合气体质量为m(混)=0.1 mol×26 g/mol=2.6 g,在烷烃与烯烃混合物中只有烯烃能够与溴水发生反应,溴水增重1.4 g为烯烃的质量,则甲烷的质量m(CH4)=2.6 g-1.4 g=1.2 g,甲烷的物质的量n(CH4)=
=0.1 mol,混合气体质量为m(混)=0.1 mol×26 g/mol=2.6 g,在烷烃与烯烃混合物中只有烯烃能够与溴水发生反应,溴水增重1.4 g为烯烃的质量,则甲烷的质量m(CH4)=2.6 g-1.4 g=1.2 g,甲烷的物质的量n(CH4)=![]() =0.075 mol,则烯烃的物质的量为n(烯烃)=0.1 mol-0.075 mol=0.025 mol,设烯烃的化学式为CnH2n,则烯烃的摩尔质量M(CnH2n)=
=0.075 mol,则烯烃的物质的量为n(烯烃)=0.1 mol-0.075 mol=0.025 mol,设烯烃的化学式为CnH2n,则烯烃的摩尔质量M(CnH2n)=![]() =56 g/mol,12n+2n=56,解得n=4,故该烯烃分子式为C4H8;
=56 g/mol,12n+2n=56,解得n=4,故该烯烃分子式为C4H8;
(4)分子式为C4H8的单烯烃为丁烯,有4种烯烃的同分异构体,分别是1-丁烯、2-丁烯(顺反两种结构)、2-甲基-1-丁烯,它们的结构简式分别为:CH2=CH—CH2CH3、 、
、 、
、![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。