题目内容
【题目】关于二氧化硫的下列叙述中,正确的是( )
A.能使含有酚酞的氢氧化钠溶液褪色,体现了二氧化硫的漂白性
B.二氧化硫能使石蕊溶液先变红色再褪色,体现了二氧化硫的酸性和漂白性
C.二氧化硫、氯气都能使品红溶液褪色,但原理不同
D.二氧化硫通入足量氯化钙溶液,能生成白色的亚硫酸钙沉淀
【答案】C
【解析】
A.使含有酚酞的氢氧化钠溶液褪色,可能是SO2与NaOH反应,也可能是二氧化硫漂白了酚酞,A不正确;
B.二氧化硫能使石蕊溶液变红色但不褪色,B不正确;
C.二氧化硫、氯气都能使品红溶液褪色,前者为非氧化还原反应,后者为氧化还原反应,C正确;
D.二氧化硫通入足量氯化钙溶液中不发生反应,没有白色沉淀生成,D不正确;
故选C。

【题目】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 实验操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液。 | 试管A、B中均未明显见到有气泡产生。 |
(1)实验①的目的是___________________________________________,实验中滴加FeCl3溶液的目的是________________________________。
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是________________________________________________________(用实验中所提供的几种试剂)。
(3)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图甲所示,则A、B、C三点所表示的瞬时反应速率最慢的是_____________。
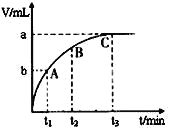
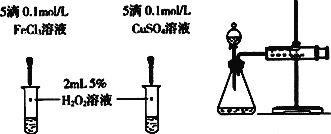
甲 乙 丙
(4)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图乙、丙所示的实验。请回答相关问题:
①定性如图乙可通过观察_________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________________________。
②定量用图丙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是______________________________。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。

