题目内容
【题目】已知下列热化学方程式:
(1)CH4(g)+2O2(g)==CO2(g)+2H2O(l) △H= - 890.0kJ/mol
(2)2C2H6(g)+7O2(g)==4CO2(g)+6H2O(l) △H= - 3119.6kJ/mol
(3)C2H4(g)+3O2(g)==2CO2(g)+2H2O(l) △H= - 1411.0kJ/mol
(4)2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) △H= - 2599.2kJ/mol
(5)C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) △H= - 2219.9kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出2970.8kJ热量,则下列哪些组合是不可能的 ( )
A. CH4和C3H8 B. C2H4和C3H8 C. C2H6和C3H8 D. C2H6和CH4
【答案】C
【解析】
两种烃组合成的混合气体2mol,经充分燃烧后放出2970.8kJ热量,则平均1mol混合气体燃烧放出热量是1485.4kJ,根据平均值法,则每种物质1mol产生的热量只要有一种大于1485.4kJ,一种小于1485.4kJ即可,据此分析可得结论。
A. 1molCH4和C3H8的混合物完全燃烧放出的热量介于890.0kJ—2219.9kJ之间,符合要求,故A可能;
B.1molC2H4和C3H8的混合物完全燃烧放出的热量介于1411.0kJ—2219.9kJ之间,符合要求,故B可能;
C.1molC2H6和C3H8的混合物完全燃烧放出的热量介于![]() kJ—2219.9kJ之间,不符合要求,故C不可能;
kJ—2219.9kJ之间,不符合要求,故C不可能;
D.1molC2H6和CH4的混合物完全燃烧放出的热量介于890.0kJ—![]() kJ之间,符合要求,故D可能;
kJ之间,符合要求,故D可能;
答案选C。

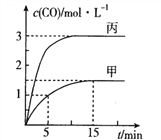
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g)△H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
容积(L) | 0.5 | 0.5 | V |
温度(℃) | T1 | T2 | T1 |
起始量 | 1mol C(s) 1mol H2O(g) | 1mol CO(g) 1mol H2(g) | 3mol C(s) 2mol H2O(g) |
下列说法正确的是
A. 甲容器中,反应在5~15mim间的平均速率v(CO)=0.15mol·L-1·min-1
B. 温度为T1℃时,反应的平衡常数K=9
C. 乙容器中,若平衡时n(C)=0.2mol,则T2<T1
D. 丙容器的体积V=0.4
【题目】海洋中蕴含着丰富的资源。利用海水提取淡水、溴和镁的部分过程如图所示。
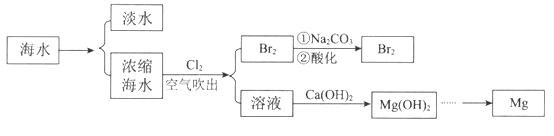
(1)海水淡化的方法有_________________、离子交换法和电渗析法等。
(2)用纯碱吸收浓缩海水吹出的Br2:
3Br2+ 6Na2CO3+3H2O= 5NaBr+ NaBrO3+6NaHCO3。当吸收3 mol Br2时,反应中转移的电子数是_____________。
(3)海水中部分离子的含量如下:
成分 | 含量( mg/L) | 成分 | 含量( mg/L) |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
其中,Mg2+的物质的量浓度是____________。若要从100 L的海水中提取镁,理论上需要加入沉淀剂Ca(OH)2的质量是_______________。
(4)由Mg(OH)2制单质Mg,以下方法最合适的是________________(填序号)。
A.Mg(OH)2 ![]() MgO
MgO![]() Mg
Mg
B.Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C.Mg(OH)2![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
D.Mg(OH)2 ![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)
CO2(g)+H2(g),部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是
A. 反应在t1min末的速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 平衡时CO的转化率为66.67%
C. 该温度下反应的平衡常数为1
D. 其他条件不变,若起始时,n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20mol