题目内容
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )A.Na2CO3、NaHCO3、NaCl、NH4Cl B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S D.NH4Cl、(NH4)2SO4、Na2S、NaNO3
解析:相同浓度的Na2CO3与NaHCO3相比,由于![]() 的水解能力大于
的水解能力大于![]() 的水解能力,故Na2CO3溶液的碱性比NaHCO3的强;NaCl、NaNO3为中性的强酸强碱盐溶液;(NH4)2SO4、NH4Cl为强酸弱碱盐溶液,存在
的水解能力,故Na2CO3溶液的碱性比NaHCO3的强;NaCl、NaNO3为中性的强酸强碱盐溶液;(NH4)2SO4、NH4Cl为强酸弱碱盐溶液,存在![]() +H2O
+H2O![]() NH3·H2O+H+的水解平衡,其中(NH4)2SO4中c(
NH3·H2O+H+的水解平衡,其中(NH4)2SO4中c(![]() )大,其c(H+)大。在Na2S溶液中存在:S2-+H2O
)大,其c(H+)大。在Na2S溶液中存在:S2-+H2O![]() HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O![]() H2S+OH-,使c(OH-)>c(H+),溶液呈碱性。C选项正确。
H2S+OH-,使c(OH-)>c(H+),溶液呈碱性。C选项正确。
答案:C

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
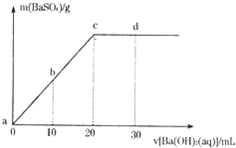 常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入物质的量浓度相同的Ba(OH)2溶液,生成沉淀的质量和加入Ba(OH)2溶液的体积关系如下图所示,下列有关说法正确的是( )| A、溶液的导电能力:a>b>c>d | B、溶液的pH:a<b<c<d | C、c点溶液和d点溶液均呈碱性 | D、b点溶液中c(H+)和d点溶液中c(OH-)相等 |