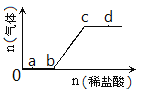
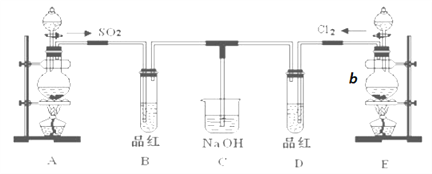
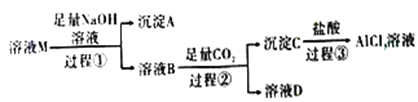
题目内容
【题目】纯水中c(H+ )=5.0×10﹣7 mol/L,则此时纯水中的c(OH﹣)=;若温度不变,滴入稀硫酸使c(H+)=5.0×10﹣3mol/L,则c(OH﹣)=;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH﹣)=5.0×10﹣2 mol/L,则溶液中c(H+ )= .
【答案】5.0×10﹣7mol/L;5.0×10﹣11mol/L;5.0×10﹣12mol/L
【解析】解:纯水显示中性,c(OH﹣)=c(H+)=5.0×10﹣7mol/L; 此温度下,水的离子积为:Kw=5.0×10﹣7×5.0×10﹣7=2.5×10﹣13 ,
若温度不变,滴入稀硫酸使c(H+)=5.0×10﹣3mol/L,硫酸溶液中氢离子浓度c(H+)=5.0×10﹣3mol/L,c(OH﹣)= ![]() mol/L=5.0×10﹣11 mol/L,
mol/L=5.0×10﹣11 mol/L,
在该温度时,往水中滴入NaOH溶液,溶液中的c(OH﹣)=5.0×10﹣2mol/L,则溶液中c(H+)= ![]() mol/L=5.0×10﹣12mol/L,
mol/L=5.0×10﹣12mol/L,
所以答案是:5.0×10﹣7mol/L;5.0×10﹣11mol/L;5.0×10﹣12mol/L.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目