��Ŀ����
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ�����ʣ���������µ�ʵ��װ�á�
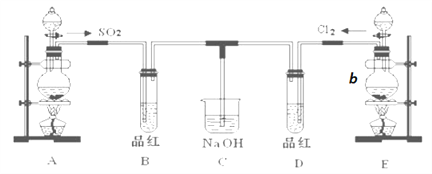
��1��ʵ������װ��A�Ʊ�SO2���Լ���������________��
a��ϡ H2SO4��Cu b��ŨHNO3��Na2SO3 c��70% H2SO4��K2SO3
��2��ʵ������װ��E�Ʊ�Cl2������b��װ��MnO2��ĩ��д������b������_______����ʵ���Ʊ�Cl2�Ļ�ѧ����ʽ ___________________________�����÷�Ӧ����8.7g����������μӷ�Ӧ�Ļ�ԭ�������ʵ���Ϊ_____________mol��
��3����Ӧ��ʼһ��ʱ��۲쵽B�Թ��е�Ʒ����Һ���ֵ������ǣ�_____________����ȫ��Ӧ��,ֹͣͨ��,�ٸ�D�Թܼ��ȣ�D�Թ�������__________________��
��4��Cװ�õ�������_______________________��
��5����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ���û�ѧ����ʽ��ʾ��________________________��
���𰸡� c Բ����ƿ MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O 0.2 ��Һ��ɫ��ɫ �������������Һ���ٻָ�Ϊ��ɫ ����δ��Ӧ���SO2��Cl2,��ֹ�ŵ���������Ⱦ���� SO2+Cl2+2H2O=H2SO4+2HCl
MnCl2+Cl2��+2H2O 0.2 ��Һ��ɫ��ɫ �������������Һ���ٻָ�Ϊ��ɫ ����δ��Ӧ���SO2��Cl2,��ֹ�ŵ���������Ⱦ���� SO2+Cl2+2H2O=H2SO4+2HCl
�����������⿼��ʵ�鷽����������ۣ���1��a��ͭ��ϡ���������Ӧ����a����b���������ǿ�����ԣ��ܰ�SO2������SO42������b����c������K2SO3��H2SO4=K2SO4��SO2����H2O����c��ȷ����2������bΪԲ����ƿ���Ʊ������ķ�Ӧ����ʽΪ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��MnO2��Ũ���ᷴӦ��HCl�ڴ˷�Ӧ��һ��������ԭ����һ���������ԣ�1molMnO2��������ʱ����2molHCl����ԭ������8.7gMnO2�����ģ���8.7��2/87mol=0.2molHCl����ԭ����3��SO2��ʹƷ����Һ��ɫ�����װ��B��������Ʒ����Һ��ɫ��Cl2��ˮ��Ӧ����HClO��HCl��HClO����ǿ�����ԣ��ܰ�Ʒ����������ɫ���ʣ�����ʱ���������������Һ���ָ�Ϊ��ɫ����4��SO2��Cl2�ж���Ϊ��ֹ��Ⱦ����������β�����������NaOH�������dz�ȥδ��Ӧ��SO2��Cl2����ֹ��Ⱦ��������5����������ǿ�����ԣ�SO2���л�ԭ�ԣ����߷�ӦSO2��Cl2��2H2O=H2SO4��2HCl��ϡ�����HCl������Ư���ԣ���˰���SO2��Cl21��1ͨ������Һ����Ư������
MnCl2+Cl2��+2H2O��MnO2��Ũ���ᷴӦ��HCl�ڴ˷�Ӧ��һ��������ԭ����һ���������ԣ�1molMnO2��������ʱ����2molHCl����ԭ������8.7gMnO2�����ģ���8.7��2/87mol=0.2molHCl����ԭ����3��SO2��ʹƷ����Һ��ɫ�����װ��B��������Ʒ����Һ��ɫ��Cl2��ˮ��Ӧ����HClO��HCl��HClO����ǿ�����ԣ��ܰ�Ʒ����������ɫ���ʣ�����ʱ���������������Һ���ָ�Ϊ��ɫ����4��SO2��Cl2�ж���Ϊ��ֹ��Ⱦ����������β�����������NaOH�������dz�ȥδ��Ӧ��SO2��Cl2����ֹ��Ⱦ��������5����������ǿ�����ԣ�SO2���л�ԭ�ԣ����߷�ӦSO2��Cl2��2H2O=H2SO4��2HCl��ϡ�����HCl������Ư���ԣ���˰���SO2��Cl21��1ͨ������Һ����Ư������