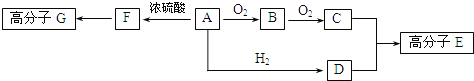
题目内容
【题目】为测定某铜和氧化铜的混合物中铜元素的质量分数,某同学设计了如图所示实验装置。
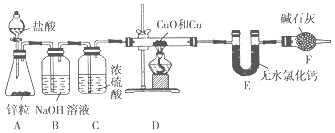
回答下列问题:
(1))装置A中盛装盐酸的仪器的名称为____________。
(2)实验时装置A中可观察到的现象________________________________________ ;发生反应的离子方程式为__________________________________________________。
(3)装置B的作用是_______________________________________________________。
(4)在加热装置D之前,应该进行的一步操作是________________________________,目的是_____________。
【答案】 分液漏斗 锌粒逐渐溶解,有气泡产生 Zn+2H+===Zn2++H2↑ 除去氢气中的HCl 在装置F的出口处收集H2,并检验H2的纯度 确保装置内空气已排尽,以防止加热时发生爆炸
【解析】本题主要考查实验室制取氢气的实验方法。
(1))装置A中盛装盐酸的仪器的名称为分液漏斗。
(2)实验时装置A中可观察到的现象:锌粒逐渐溶解,有气泡产生;发生反应的离子方程式为Zn+2H+===Zn2++H2↑。
(3)盐酸具有挥发性,致使氢气含有氯化氢杂质,装置B的作用是除去氢气中的HCl。
(4)在加热装置D之前,应该进行的一步操作是有气泡产生置F的出口处收集H2,并检验H2的纯度,目的是确保装置内空气已排尽,以防止加热时发生爆炸。

练习册系列答案
相关题目