题目内容
1.有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:(1)写出C、D的元素名称:C钠 D氯.
(2)写出化学方程式:
①C+B=2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
②上述黄色固态物质与B的常见氢化物反应:2Na2O2+2H2O=4NaOH+O2↑、黄色固态物质反应1mol时,发生转移的电子数为NA.
(3)C元素离子的离子结构示意图
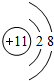 ,D元素位于周期表中的位置第三周期第ⅤⅡA族.
,D元素位于周期表中的位置第三周期第ⅤⅡA族.
分析 A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,A和C原子最外层只有一个电子,说明A和C为第ⅠA族元素,C燃烧时的焰色反应是黄色,则C为Na元素,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,可知B为O元素,生成的淡黄色固体为过氧化钠,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,应为氢气与氯气的反应,则A为H元素,D为Cl元素,据此答题.
解答 解:A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,A和C原子最外层只有一个电子,说明A和C为第ⅠA族元素,C燃烧时的焰色反应是黄色,则C为Na元素,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,可知B为O元素,生成的淡黄色固体为过氧化钠,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,应为氢气与氯气的反应,则A为H元素,D为Cl元素.
(1)由以上分析可知,C、D的元素名称分别为钠、氯,
故答案为:钠;氯;
(2)①钠在加热条件下和氧气反应生成过氧化钠,反应方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;
②过氧化钠与水反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠起氧化剂、还原剂作用,各占一半,故转移电子数目为1mol×$\frac{1}{2}$×2×[0-(-1)]×NAmol-1=NA,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;NA;
(3)C钠元素,钠离子的离子结构示意图为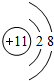 ,D为氯元素,位于周期表中第三周期第ⅤⅡA族,
,D为氯元素,位于周期表中第三周期第ⅤⅡA族,
故答案为: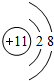 ;第三周期第ⅤⅡA族.
;第三周期第ⅤⅡA族.
点评 本题考查结构性质位置关系综合应用,难度不大,正确推断元素是解本题的关键,注意对基础知识的理解掌握.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案①25℃时亚硝酸钠溶液的pH大于7
②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol•L-1 HNO2溶液的pH=2.1.
| A. | ①②③ | B. | ②③④ | C. | ①④ | D. | ①②④ |
| A. | 在标准状况下,22.4LSO3所含的硫原子数目为NA | |
| B. | 常温常压下,7.8g过氧化钠含有的离子数为0.3NA | |
| C. | 18 g 水所含的电子数目为10 NA | |
| D. | 3.2g O2、O3混合物中所含氧原子一定是0.2NA |
| A. | Cl | B. | O | C. | Mg | D. | Na |
| A. | CH3CH2OH→CH3CHO | B. | Fe2O3→Fe(OH)3 | C. | SiO2→H2SiO3 | D. | Al2O3→Al(OH)3 |
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=-Q kJ/mol(Q>0) |
| A. | X和Y都是非金属元素,其中X的最高化合价为+5价 | |
| B. | X与Y所能形成的化合物都是酸性氧化物 | |
| C. | 元素X的氧化物的水化物是强酸 | |
| D. | X的氢化物极易溶于水,可以用来做喷泉实验 |
 ;B的结构简式为
;B的结构简式为 ;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式
;与A含有相同种类和数目的官能团(包括苯环)、且苯环上取代基位置和数量也相同的同分异构体有多种,写出其中任意一种的结构简式 (不包括原化合物,不考虑立体异构).
(不包括原化合物,不考虑立体异构).