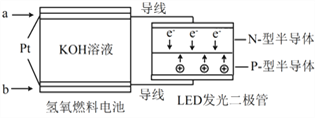
题目内容
【题目】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O ![]() Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 ![]() CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________(填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
(3)第④步中发生反应的化学方程式是_______________________。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________。

装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
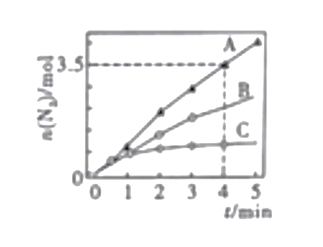
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
【答案】 CuO或Cu(OH)2或Cu2(OH)2CO3 将溶液转移至蒸发皿中,控制温度(不高于170℃,防止硝酸铜水解),加热至溶液表面形成一层晶膜 减慢冷却结晶的速度或冷却后静置较长时间 Cu(NO3)23H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCl↑ 在AB之间增加干燥装置,防止B中的水蒸气进入A中 b 92.5%
【解析】为提高铜的浸取率,所用硝酸必然是过量的,此时铁也溶解转化为硝酸铁,调pH的目的是除去铁离子。然后蒸发浓缩、降温结晶得到硝酸铜晶体,最后在SOCl2的保护下脱去结晶水得到无水硝酸铜,据此解答。
(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,因此第②步调pH适合的物质是CuO或Cu(OH)2或Cu2(OH)2CO3;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)23H2O变质,故蒸发浓缩应将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜减慢冷却结晶的速度,可得到较大颗粒的Cu(NO3)23H2O晶体;
(3)根据以上分析可知第④步中发生反应的化学方程式是Cu(NO3)23H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCl↑;
(4)第④步,某同学设计的实验装置有一处不合理,根据装置图可知应该是氢氧化钠溶液中的水蒸气可以进入A中影响A中的硝酸铜晶体脱水反应。改进的方法是在AB之间增加干燥装置,理由是防止B中的水蒸气进入A中;装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞b。
(5)由图像可知,A=0.620时,对应的溶液中c(Cu2+)=1.55×10-3mol/L,则n[Cu(NO3)2]=100mL/10mL×0.1L×1.55×10-3mol/L=1.55×10-3mol,则无水Cu(NO3)2产品的纯度是1.55×10-3×188/0.3150×100%=92.5%。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案