题目内容
【题目】某同学设计了一组电化学装置如图所示,其中乙装置中 X 为阳离子交换膜,甲醇(CH3OH)具有可燃性。
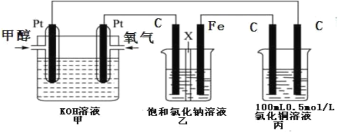
根据要求回答相关问题:
(1)写出装置甲中负极的电极反应式:________。
(2)装置乙中石墨电极(C)的电极反应式为:_________。
(3)当装置甲中消耗 0.05molO2 时,丙装置中阳极产生气体的体积 ____________L(标况下);
(4)若按(3)数据,装置乙中溶液的 pH 为_____________(溶液体积为 200mL 不变)。要使乙中溶液恢复到原来的状态,需要加入的物质是__________,对应用量为___________mol.
【答案】CH3OH6e+8OH═CO32+6H2O 2Cl2e=Cl2↑ 1.68 14 HCl 0.2
【解析】
(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为:CH3OH6e+8OH═CO32+6H2O,正极发生还原反应,电极方程式为O2+2H2O+4e═4OH;
故答案为:CH3OH6e+8OH═CO32+6H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl2e═Cl2↑;
故答案为: 2Cl2e=Cl2↑;
(3)当装置甲中消耗0.05molO2时,由电极方程式O2+2H2O+4e═4OH可知转移0.2mol电子,装置丙中阳极电极反应为:2Cl2e=Cl2↑,4OH4e=2H2O+O2↑,氯化铜物质的量n=0.1L×0.5mol/L=0.05mol,n(Cl)=0.1mol,生成氯气电子转移0.1mol,生成氯气物质的量0.05mol,则氢氧根离子电解反应电子转移0.1mol,生成氧气0.025mol,生成气体物质的量=0.05mol+0.025mol=0.075mol,标准状况下气体体积=0.075mol×22.4L/mol=1.68L;
故答案为:1.68;
(4)装置乙中阴极发生2H2O+2e=H2+2OH,可知生成0.2molOH,溶液体积为200mL,则c(OH)=1mol/L,则pH=14。
若复原至原状态,需HCl气体0.2mol;
故答案为:14;HCl; 0.2。

 阅读快车系列答案
阅读快车系列答案