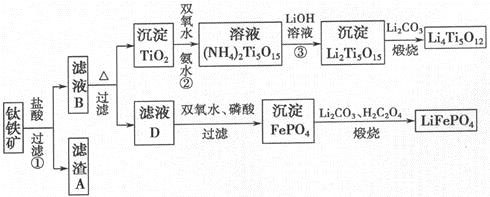
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΫΪ32.64gΆ≠”κ140mL“ΜΕ®≈®Ε»ΒΡœθΥαΖ¥”ΠΘ§Ά≠Άξ»Ϊ»ήΫβΘ§≤ζ…ζΒΡNOΚΆNO2ΜλΚœΤχΧε‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐΈΣ11.2LΘ§«κΜΊ¥πΘΚ
Θ®1Θ©NOΒΡΧεΜΐΈΣLΘ§NO2ΒΡΧεΜΐΈΣLΘ°
Θ®2Θ©ΫΪ≤ζ…ζΒΡΤχΧε»Ϊ»Ϊ ΆΖ≈ΚσΘ§œρ»ή“Κ÷–Φ”»κVmLamolL©¹1ΒΡNaOH»ή“ΚΘ§«ΓΚΟ Ι»ή“Κ÷–ΒΡCu2+»Ϊ≤ΩΉΣΜ·ΈΣ≥ΝΒμΘ§‘ρ‘≠œθΥα»ή“ΚΒΡ≈®Ε»ΈΣmolL©¹1 Θ°
Θ®3Θ©»τΆ≠”κœθΥαΗ’ΚΟΖ¥”ΠΆξ»ΪΘ§‘ρ‘≠œθΥα»ή“ΚΒΡ≈®Ε»ΈΣmolL©¹1 Θ°
ΓΨ¥πΑΗΓΩ
Θ®1Θ©5.8ΘΜ5.4
Θ®2Θ©![]()
Θ®3Θ©10.86
ΓΨΫβΈωΓΩΫβΘΚnΘ®CuΘ©= ![]() =0.51molΘ§nΘ®NOΘ©+nΘ®NO2Θ©=
=0.51molΘ§nΘ®NOΘ©+nΘ®NO2Θ©= ![]() =0.5molΘ§Θ®1.Θ©…ηNOΒΡΈΣxmolΘ§NO2ΒΡΈΣymolΘ§
=0.5molΘ§Θ®1.Θ©…ηNOΒΡΈΣxmolΘ§NO2ΒΡΈΣymolΘ§
“ρΈΣΆ≠”κœθΥαΒΡΖ¥”Π «“ΜΗω―θΜ·ΜΙ‘≠Ζ¥”ΠΘ§ΗυΨίΧβ“βΦΑΒγΉ”ΒΟ ß ΊΚψΘ§”–ΘΚ ![]() Θ§
Θ§
Ϋβ÷°ΒΟx=0.26Θ§y=0.24Θ§
‘ρVΘ®NOΘ©=0.26molΓΝ22.4L/molΓ÷5.8LΘ§
VΘ®NO2Θ©=0.24molΓΝ22.4L/molΓ÷5.4LΘ§Υυ“‘¥πΑΗ «ΘΚ5.8ΘΜ5.4ΘΜ
Θ®2.Θ©Β±Cu2+»Ϊ≤ΩΉΣΜ·≥…≥ΝΒμ ±Θ§»ή“Κ÷–ΒΡ»ή÷ ΈΣNaNO3 Θ§ “ρ¥ΥΘ§ΗυΨίΒΣ‘ΣΥΊ ΊΚψΘ§HNO3ΒΡΈο÷ ΒΡΝΩΈΣnΘ®Na+Θ©+nΘ®NOΘ©+nΘ®NO2Θ©Θ§
nΘ®Na+Θ©=nΘ®NaOHΘ©=aVΓΝ10©¹3molΘ§
nȮNOȩ+nȮNO2ȩ=0.5molȧ
‘ρ‘≠œθΥα»ή“ΚΒΡ≈®Ε»ΈΣ ![]() =
= ![]() mol/Lȧ
mol/Lȧ
Υυ“‘¥πΑΗ «ΘΚ ![]() ΘΜ
ΘΜ
Θ®3.Θ©»τΆ≠”κœθΥαΗ’ΚΟΖ¥”ΠΆξ»ΪΘ§Ζ¥”Π…ζ≥…œθΥαΆ≠ΓΔNOΚΆNO2 Θ§
”…N‘≠Ή” ΊΚψΩ…÷ΣΘΚnΘ®HNO3Θ©=2nΘ®CuΘ®NO3Θ©2Θ©+nΘ®NOΘ©+nΘ®NO2Θ©=0.51molΓΝ2+0.5mol=1.52molΘ§‘ρ‘≠œθΥα»ή“ΚΒΡ≈®Ε»ΈΣ ![]() =10.86mol/LΘ§Υυ“‘¥πΑΗ «ΘΚ10.86Θ°
=10.86mol/LΘ§Υυ“‘¥πΑΗ «ΘΚ10.86Θ°