题目内容
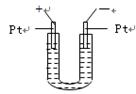
有一硝酸盐晶体,其化学式为M(NO3)x·yH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.01mol电子发生转移时,溶液中金属恰好全部析出,经称量阴极增重0.32g。求:
(1)金属M的相对原子质量及x、y。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
(1)金属M的相对原子质量及x、y。
(2)电解后溶液的pH(电解过程中溶液体积变化忽略不计)。
(1)n(M)=n[M(NO3)x·yH2O]=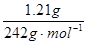 =0.005mol
=0.005mol
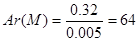 M的化合价=
M的化合价=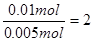 所以x="2"
所以x="2"
根据64+2(14+48)+18y=242 得y="3"
(2)电解总反应为:
2M(NO3)2+2H2O= 2M + 4HNO3 +O2↑
2 4
0.005mol y
y(HNO3)=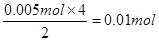
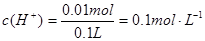
pH = -lg10-1 = 1
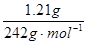 =0.005mol
=0.005mol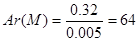 M的化合价=
M的化合价=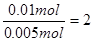 所以x="2"
所以x="2" 根据64+2(14+48)+18y=242 得y="3"
(2)电解总反应为:
2M(NO3)2+2H2O= 2M + 4HNO3 +O2↑
2 4
0.005mol y
y(HNO3)=
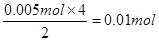
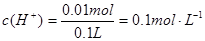
pH = -lg10-1 = 1
试题分析:由题知用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g,故A极为阴极;析出的金属电极反应为:
Mx+ + xe- ═ M
1 x M
0.005mol 0.01mol 0.32g
计算得到M=64g/mol;
x=2;
M(NO3)x?yH2O经测定其摩尔质量为242g?mol-1.
64+62×2+18y=242
y=3;
溶液中电解方程式为:2M2++2HO
 2M+O2↑+4H+,已知电解生成M为0.32g,则n(M)=
2M+O2↑+4H+,已知电解生成M为0.32g,则n(M)=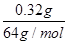 =0.005mol,所以n(H+)=2n(M)=0.01mol,所以c(H+)=
=0.005mol,所以n(H+)=2n(M)=0.01mol,所以c(H+)=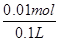 =0.1mol/L,则pH=1,
=0.1mol/L,则pH=1,答:电解结束后溶液的pH为1。

练习册系列答案
相关题目
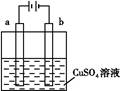
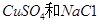 的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是
的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是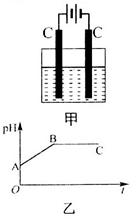
 导致了A点溶液的pH值小于B点
导致了A点溶液的pH值小于B点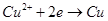


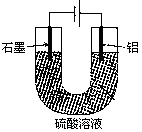
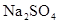 溶液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:( )
溶液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:( )