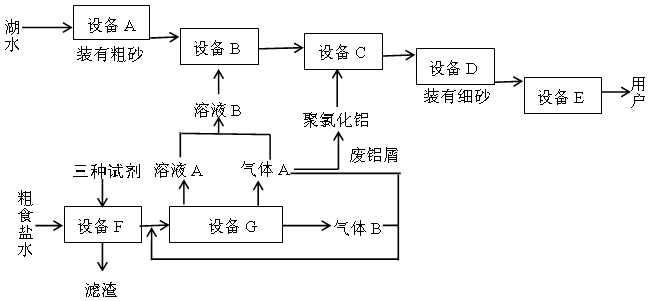
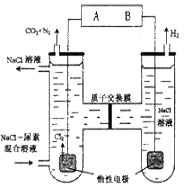
题目内容
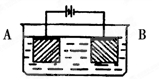
如图用石墨电极电解CuCl2溶液。下列分析正确的是( )


| A.a极发生还原反应 |
| B.每生成6.4 g Cu,转移电子0.2 mol |
C.阳极反应式: |
| D.在直流电源中电流从b流向a |
A
试题分析:本题考查电解原理。与电源的正极的电极为阳极,带正电,溶液中阴离子向阳极移动,根据图示可知,b为电源的正极,a为电源的负极,电子从电源负极流出即失电子发生氧化反应,A错误;每生成6.4 g Cu即为0.1mol转移电子是0.2 mol,正确。阴离子Cl-在阳极上发生氧化反应2Cl--2e-=Cl2,C不正确;在直流电源中电流从a流向b,D不正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目