题目内容
【题目】2019年为元素周期表年,元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
A | ||||||||
D | F | |||||||
G | Q | M | R | |||||
N | ... ... | T | ||||||
(1)表中金属性最强的元素是___(填元素符号),它在元素周期表中的位置是____。
(2)元素的非金属性:Q___F(填“>”或“<”)。
(3)D的最高价氧化物对应水化物的化学式是______。
(4)F、G两元素可形成的淡黄色固体物质,该物质含有的化学键的类型是_和__。
(5)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_。
(6)表中M、R和N元素的原子都可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是_____(填离子符号)。
(7)A与D形成分子的空间结构可能是(填序号)____。
a ![]() b
b ![]() c
c 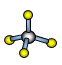 d
d 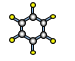
【答案】K 第四周期IA族 < HNO3 离子键 (非极性)共价键 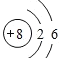 S2->Cl->K+ a
S2->Cl->K+ a
【解析】
根据元素在周期表中的位置,可判断A~T 9种元素分别为H、N、O、Na、Si、S、Cl、K、Br。
(1)根据元素周期律,周期表的左下元素的金属性最强,9种元素中K的金属性最强;其位于第四周期IA族;
(2)同理,周期表中除稀有气体外,越向右上角靠拢的非金属,其非金属性越强,元素的非金属性:Si<O;
(3)D为N,其最高价氧化物对应水化物为硝酸,化学式是HNO3;
(4)F、G两元素分别为O、Na,形成的淡黄色固体物质为过氧化钠,为离子化合物,存在离子键、非极性共价键;
(5)表中某元素原子的核外电子层数是最外层电子数的3倍,若为1层,则最外层为3>2,与事实不符;若为2,最外层为6,即核外有8个电子,为O;若为3层,最外层为9,大于8与事实不符,综上所述,该元素为O,原子结构示意图为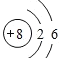 ;
;
(6)表中M、R和N元素分别为S、Cl、K,其离子与Ar具有相同电子层结构,其原子序数越大,离子半径越小,离子的半径由大到小的顺序是S2->Cl->K+;
(7)A与D分别为H、N,形成的简单化合物为氨,即NH3,空间结构为三角锥形,选a。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案