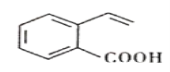
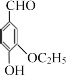
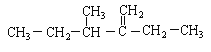题目内容
【题目】如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
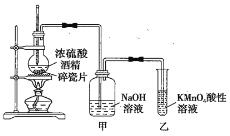
请回答下列问题。
(1)烧瓶中碎瓷片的作用是__,装置中的明显错误是__。
(2)实验步骤:①_;②在各装置中注入相应的试剂(如图所示);③__。实验时,烧瓶中液体混合物逐渐变黑。
(3)能够说明乙烯具有还原性的现象是__;装置甲的作用是__。若无甲装置,是否也能检验乙烯具有还原性?_(填“能”或“不能”),简述其理由:__。
【答案】防止暴沸 温度计水银球没有插入反应液中 组装仪器,检查装置的气密性 加热,使温度迅速升至170℃ 乙中KMnO4酸性溶液紫色褪去 除去乙烯中混有的SO2等气体 不能 SO2具有还原性,也可以使KMnO4酸性溶液褪色
【解析】
(1)加热液体时,碎瓷片的作用是防止暴沸;装置中温度计需要测定反应液的温度,而图中温度计水银球没有插入反应液中;
(2)①制取气体的装置的气密性必须良好,实验前需要检查;③实验室制乙烯的反应条件是使反应混合物的温度迅速升至170℃,从而减少乙醚的生成;
(3)乙烯具有还原性是根据氧化剂![]() 酸性溶液褪色来判断的;由于烧瓶中混合物变黑,则说明生成了碳,联想浓硫酸具有强氧化性,可推出乙烯中混有还原性气体
酸性溶液褪色来判断的;由于烧瓶中混合物变黑,则说明生成了碳,联想浓硫酸具有强氧化性,可推出乙烯中混有还原性气体![]() ,由于
,由于![]() 也会使
也会使![]() 酸性溶液褪色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净
酸性溶液褪色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净![]() ,则装置甲的作用是除去
,则装置甲的作用是除去![]() 。
。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案【题目】利用碳和水蒸气制备水煤气的核心反应为:C(s)+H2O(g)H2(g)+CO(g)
(1)已知碳(石墨)、H2、CO的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1、283kJ·mol-1,又知H2O(l)=H2O(g) ΔH=+44kJ·mol-1,则C(s)+H2O(g)CO(g)+H2(g) ΔH=___。
(2)在某温度下,在体积为1L的恒容密闭刚性容器中加入足量活性炭,并充入1mol H2O(g)发生上述反应,反应时间与容器内气体总压强的数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体总物质的量为________mol,H2O的转化率为________。
②该温度下反应的平衡分压常数Kp=________kPa(结果保留2位有效数字)。
(3)保持25℃、体积恒定的1L容器中投入足量活性炭和相关气体,发生可逆反应C+H2O(g)CO+H2并已建立平衡,在40 min时再充入一定量H2,50min时再次达到平衡,反应过程中各物质的浓度随时间变化如图所示:
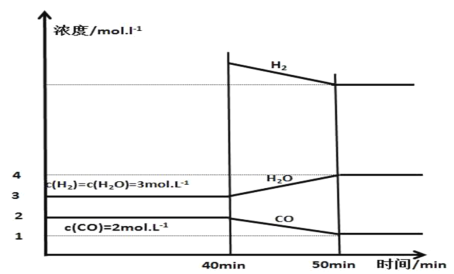
①40min时,再充入的H2的物质的量为________mol。
②40~50 min内H2的平均反应速率为________mol·L-1·min-1。
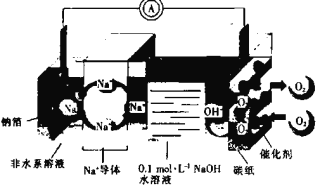
(4)新型的钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
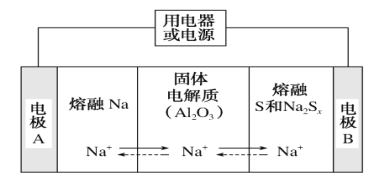
①放电时,电极A为________极,S发生________反应(填“氧化”或“还原”)。
②充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源________极相连,阳极的电极反应式为_________。