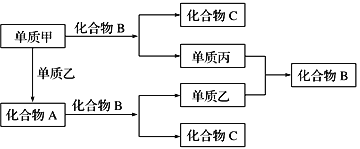
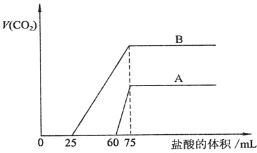
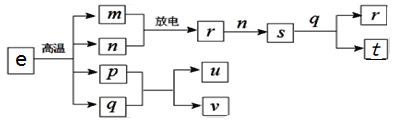
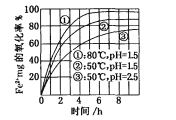
题目内容
【题目】如图所示是用石墨和铁作电极电解饱和食盐水的装置,请填空:
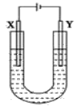
(1)X的电极名称是________极,发生的电极反应式为:_______________________。Y极的电极材料是__________,检验X极产物的方法是___________________________________________。
(2)写出该电极总反应的离子方程式:___________________________________。
(3)若食盐水为100mL 两极共放出2.24L气体(标准状况),则电路中通过电子的物质的量为___________。(假定电解后仍为100mL)
【答案】 阳 2Cl--2e-=Cl2↑ Fe 用湿润的淀粉-碘化钾试纸放在X极附近,若试纸变蓝,说明Cl2产生 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 0.1mol
2OH-+H2↑+Cl2↑ 0.1mol
【解析】(1)用石墨和铁作电极电解饱和食盐水,根据反应,则铁作阴极,溶液中的氢离子在铁电极上得电子生成氢气,石墨作阳极,溶液中的氯离子在石墨上失电子生成氯气,根据氯气能使湿润的淀粉碘化钾试纸变蓝来检验;
(2)电解饱和食盐水生成氢氧化钠、氢气和氧气;
(3)根据反应2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑计算转移电子数。
2OH-+H2↑+Cl2↑计算转移电子数。
(1)用石墨和铁作电极电解饱和食盐水,根据反应,则铁作阴极,应为Y,溶液中的氢离子在铁电极上得电子生成氢气,石墨作阳极,应为X,溶液中的氯离子在石墨上失电子生成氯气,电极反应为2Cl--2e-=Cl2↑;由于氯气能使湿润的淀粉碘化钾试纸变蓝来检验,所以检验X极的产物方法是用湿润的淀粉-碘化钾试纸放在X极附近,若试纸变蓝,说明有Cl2产生;
(2)电解饱和食盐水生成氢氧化钠、氢气和氧气,方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(3)电解饱和食盐水生成氢氧化钠、氢气和氧气,即2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,两极放出2.24L即0.1mol气体(标准状况),由方程式可知产生2mol气体转移2mol电子,则电路中通过电子的物质的量为0.1mol。
2OH-+H2↑+Cl2↑,两极放出2.24L即0.1mol气体(标准状况),由方程式可知产生2mol气体转移2mol电子,则电路中通过电子的物质的量为0.1mol。

【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_______(填具体元素符号或化学式,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的子式是_________,第三周期中碱性最强的化合物的化学式是____________________。
(3)最高价氧化物是两性氧化物的元素是____________;写出它最高价氧化物对应水化物与氢氧化钠反应的化学方程式_______________________________________。
(4)用电子式表示元素④与⑥形成化合物的形成过程:________________________,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)表示③与①最高价态形成的化合物电子式___________________,该化合物分子由___________(填“极性”“非极性”)键形成。