题目内容
下列原子的电子排布图中,符合洪特规则的是( )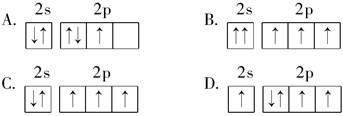

C
试题分析:洪特规则是在等价轨道(指相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,所以选项C符合,其余均是错误的,答案选C。
点评:该题是基础性试题的考查,主要是考查学生对洪特规则的了解、掌握情况,以及灵活运用洪特规则解决实际问题的能力,有利于提高学生的学习积极性和学习效率,增强学生的学习自信心。

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目

 褐色
褐色

 ;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则: 。 四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )
。 四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是( )