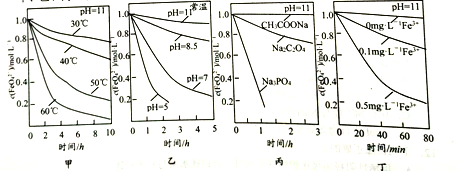
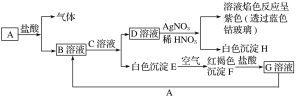
题目内容
【题目】已知:25℃时H2C2O4的pKa1=1.22,pK a2=4.19,CH3COOH的pK a=4.76(电离常数K的负对数-1gK=pK)。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性:(NH4+)<c(C2O42-)
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 0.1 mol·L-1CH3COONa溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c(HC2O4-)>c(C2O42-)>c(CH3COO-)
【答案】BC
【解析】A、由已知数据分析可得,HC2O4—的水解程度小于CH3COO—的,HC2O4—对NH4+水解的促进作用小于CH3COO—,故c(NH4+)前者大于后者,则A错误;B、向0.1 mol·L-1KHC2O 4溶液滴加氨水至中性,溶液中存在如下平衡:NH3·H2O![]() NH4++OH-,HC2O4-+H2O
NH4++OH-,HC2O4-+H2O![]() H2C2O4+OH-,HC2O4-
H2C2O4+OH-,HC2O4-![]() C2O42—+H+,因为c(OH-) =c(H+),所以c(NH4+) +c(H2C2O4) = c(C2O42—),则(NH4+)<c(C2O42-),所以B正确;C、0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22,则生成KCl和H2C2O4,且c(H+)=10-1.22 mol·L-1,已知H2C2O4
C2O42—+H+,因为c(OH-) =c(H+),所以c(NH4+) +c(H2C2O4) = c(C2O42—),则(NH4+)<c(C2O42-),所以B正确;C、0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22,则生成KCl和H2C2O4,且c(H+)=10-1.22 mol·L-1,已知H2C2O4![]() HC2O4-+H+,Ka1=1.22,所以c(H2C2O4) = c(HC2O4—),由质子守恒可得c(H+)+ c(HC2O4—)+ 2c(H2C2O4)= c(OH-)+ c(Cl-),所以C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-),故C正确;D、溶液呈酸性即c(OH-) < c(H+),由电荷守恒可得,c(K+)+c(Na+) < c(HC2O4-)+ c(C2O42-) +c(CH3COO-),所以D错误。本题正确答案为BC。
HC2O4-+H+,Ka1=1.22,所以c(H2C2O4) = c(HC2O4—),由质子守恒可得c(H+)+ c(HC2O4—)+ 2c(H2C2O4)= c(OH-)+ c(Cl-),所以C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-),故C正确;D、溶液呈酸性即c(OH-) < c(H+),由电荷守恒可得,c(K+)+c(Na+) < c(HC2O4-)+ c(C2O42-) +c(CH3COO-),所以D错误。本题正确答案为BC。