题目内容
【题目】(变式探究)已知有以下物质相互转化。
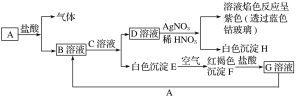
试回答下列问题:
(1)B的化学式为__________,D的化学式为________。
(2)由E转变成F的化学方程式为___________________________。
(3)用KSCN鉴别G溶液的离子方程式为_______________________;
向G溶液加入A的有关反应离子方程式为_______________________________。
【答案】FeCl2KCl4Fe(OH)2+O2+2H2O===4Fe(OH)3Fe3++3SCN-===Fe(SCN)32Fe3++Fe===3Fe2+
【解析】
分析流程图可知白色沉淀E在空气中变化为红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,F+HCl=G,推断G为FeCl3,B+C=Fe(OH)2+D溶液,D溶液和硝酸酸化的硝酸银反应生成白色沉淀H为AgCl,溶液焰色反应隔着钴玻璃为紫色,证明溶液中含有钾元素,D为KCl,证明C溶液为KOH,B溶液为FeCl2,G+A=B判断A为Fe,依据分析判断出的物质分析选项回答问题。
(1)根据以上分析可知B是氯化亚铁,化学式是FeCl2,D为氯化钾,化学式为KCl;
(2)E转变成F的反应是氢氧化亚铁被氧气氧化为氢氧化铁的反应,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G溶液为FeCl3,用KSCN鉴别的离子方程式是铁离子和硫氰酸根离子反应生成血红色溶液,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3;向G溶液FeCl3加入Fe的有关离子反应方程式为2Fe3++Fe=3Fe2+。

【题目】下列关于钠的叙述中,正确的是( )
A.钠是银白色金属,熔点低,硬度大
B.钠放置于空气中,会迅速被氧化而生成淡黄色的氧化钠
C.在氧气中加热时,金属钠剧烈燃烧,火焰呈黄色
D.金属钠着火可以用水灭火
【题目】已知:I2+2 S2O32-![]() S4O62-+2I-。相关物质的溶度积常数见下表:
S4O62-+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl22H2O晶体,加入________;调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_____________;过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体。
(2)在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2,原因是________________。(用化学方程式表示)。由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是_______________。
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。已知:CuCl2溶液与KI反应的离子方程式为Cu2+ + 4I- = 2CuI↓ + I2
①可选用___________作滴定指示剂,滴定终点的现象是_________________。
②该试样中CuCl22H2O的质量百分数为___________________________。