题目内容
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
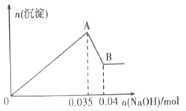
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________(填离子符号);
(2)A点沉淀的化学式___________________;
(3)写出A→B过程中发生反应的离子方程式:____________________________;
(4)该废水中,c(Al3+)=________;
【答案】Cl- Mg(OH)2 Al(OH)3 Al(OH)3 + OH- = AlO2- + H2O 0.5mol/L
【解析】
取少许该废水于管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,该沉淀为硫酸钡,则原溶液中含有SO42-;充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生,说明原溶液中不存在Cl-;另取10mL该废水于管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解,溶解的沉淀为氢氧化铝,不溶的沉淀为氢氧化镁,则原溶液中一定含有Mg2+、Al3+,钠离子不能确定。
(1)根据以上分析可知该废水中一定不含有的离子是Cl-;答案:Cl-。
(2)O→A过程中Mg2+、Al3+与氢氧化钠反应,发生反应的离子方程式为Al3++3OH-= Al(OH)3![]() +H2O;Mg2++2OH-= Mg(OH)2
+H2O;Mg2++2OH-= Mg(OH)2![]() ,所以A点沉淀的化学式Mg(OH)2
,所以A点沉淀的化学式Mg(OH)2![]() 、Al(OH)3。答案:Mg(OH)2
、Al(OH)3。答案:Mg(OH)2![]() 、Al(OH)3。
、Al(OH)3。
(3)A→B的过程中是氢氧化铝溶解,继续加氢氧化钠,发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;答案:Al(OH)3+OH-=AlO2-+2H2O。
(4)根据反应Al(OH)3+OH-=AlO2-+2H2O可知n[Al(OH)3]=n(NaOH)=0.04mol-0.035mol=0.005mol,根据离子守恒可知原溶液中铝离子的物质的量为0.005mol,则原溶液中铝离子的浓度为:0.005mol÷0.01L=0.5mol/L;答案:0.5mol/L。

【题目】在下右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b不满足题目要求的是
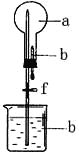
选项 | a(干燥气体) | b(液体) |
A | Cl2 | 饱和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L盐酸 |
A. A B. B C. C D. D