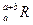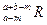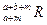题目内容
(12分)空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。
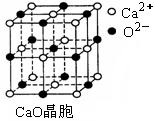
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在
燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位
数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分
别为:CaO-3 401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点 NaCl
晶体的熔点(填“高于”、“等于”或“低于”)。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。

请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为 。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
① 写出亚铁离子的基态电子排布式 。
② CO有多种等电子体,其中常见的两种为 。
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在
燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位
数为 ,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分
别为:CaO-3 401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点 NaCl
晶体的熔点(填“高于”、“等于”或“低于”)。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是: 。
⑴ N>O>S
⑵ ①1s22s22p63s23d6 ② N2、CN-
⑶6 高于
⑷甲醇分子间存在氢键,而甲醛没有
⑵ ①1s22s22p63s23d6 ② N2、CN-
⑶6 高于
⑷甲醇分子间存在氢键,而甲醛没有
A.本题考查物质与结构的性质。(1)同一周期中,第VA族由于具有半充满状态,故不易失去电子,即第一电离能比相邻元素要大。同主族元素,从上至下,半径递增,核对外层电子的吸引能力减弱,即第一电离能递减。(2)①铁为26号元素,原子的电子排布式为[Ar]3d64s2,Fe2+则失去最外层4s上面的两个电子,其排布式为[Ar]3d6。②此问考查等电子体的概念,一是要求原子数相等,二是要求最外层电子数相等。(3)Ca2+配位数即是指周围最近的阴离子数,从晶胞图不能发现,白球的周围存在上、下、左、右、前和后六种黑球。晶格能越大,即表示离子间的作用力越强,则熔沸点也越高。(4)氢键的表示方法为H—O……H,甲醇在存在其结构,故有氢键,而甲醛中存在的是碳氧双键,故不属于氢键,所以其沸点低。

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目

 。晶体中一个R微粒的核外电子数为a,核内中子数是b,则该同位素原子的符号是
。晶体中一个R微粒的核外电子数为a,核内中子数是b,则该同位素原子的符号是