题目内容
(A)四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题:

(1)B元素在周期表中的位置是_________________________,写出A原子的电子排布式__________________。
(2)写出C单质与水反应的化学方程式___________________________________________。A与C形成的化合物溶于水后,溶液的pH__________7(填“大于”、“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度________(填“大”、“小”),其理由是____________________________。
(4)A、B两元素非金属性较强的是(写元素符号)_________。写出能证明这一结论的一个实验事实_______________________________________________________。

(1)B元素在周期表中的位置是_________________________,写出A原子的电子排布式__________________。
(2)写出C单质与水反应的化学方程式___________________________________________。A与C形成的化合物溶于水后,溶液的pH__________7(填“大于”、“等于”或“小于”)。
(3)D元素最高价氧化物晶体的硬度________(填“大”、“小”),其理由是____________________________。
(4)A、B两元素非金属性较强的是(写元素符号)_________。写出能证明这一结论的一个实验事实_______________________________________________________。
(1)第三周期,ⅦA;1s22s22p63s23p6。
(2)2Na+2H2O 2NaOH+H2↑;大于
2NaOH+H2↑;大于
(3)大;SiO2是原子晶体(或小;CO2是分子晶体)
(4)Cl;高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强
(2)2Na+2H2O
 2NaOH+H2↑;大于
2NaOH+H2↑;大于(3)大;SiO2是原子晶体(或小;CO2是分子晶体)
(4)Cl;高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强
根据在氧气中燃烧为明亮的蓝紫色火焰判断A物质为硫单质;由其最外层电子排布为3s23p5则可确定为Cl元素。根据焰色反应为黄色的金属,则确定C为Na。D的最外层电子排布为2s22p2或3s23p2,判断D为Si。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
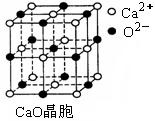
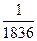
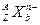 是科学家新发现的一种微粒,试求一个
是科学家新发现的一种微粒,试求一个