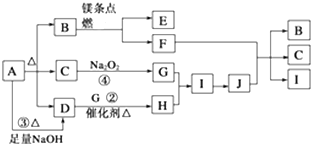
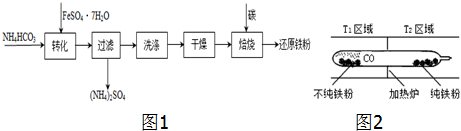
题目内容
6.25mL的盐酸溶液中加入4g氢氧化钠恰好中和,若改用氢氧化钡中和需要( )| A. | 17.1g | B. | 8.55g | C. | 34.2g | D. | 3.4g |
分析 HCl和NaOH、Ba(OH)2反应时,因为稀盐酸的物质的量相等,所以方程式可以分别写为2NaOH+2HCl=2NaCl+2H2O、Ba(OH)2+2HCl=BaCl2+2H2O,根据方程式知,消耗n[Ba(OH)2]=$\frac{1}{2}$n(NaOH),根据m=nM计算氢氧化钡质量.
解答 解:HCl和NaOH、Ba(OH)2反应时,因为稀盐酸的物质的量相等,所以方程式可以分别写为2NaOH+2HCl=2NaCl+2H2O、Ba(OH)2+2HCl=BaCl2+2H2O,根据方程式知,消耗n[Ba(OH)2]=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×$\frac{4g}{40g/mol}$=0.05mol,则m[Ba(OH)2]=0.05mol×171g/mol=8.55g,
故选B.
点评 本题考查化学方程式的有关计算,为高频考点,明确氢氧化钠、氢氧化钡关系是解本题关键,熟悉物质的量公式中各个物理量的关系,题目难度不大.

练习册系列答案
相关题目
14.下列物质属于纯净物的是( )
| A. | 金刚石、石墨的混合物 | B. | 冰、水混合物 | ||
| C. | 氨水 | D. | 盐酸 |
1.氯水成分的实验探究如下:
(1)指出实验①的结论氯水中含有Cl-.
(2)指出实验②和实验④中的实验现象:②溶液褪色;④有气泡冒出.
(3)实验③中“实验方法”的具体操作过程是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①④实验无影响.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ② | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | 氯水中含有Cl- |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | 溶液褪色 | |
| ③ | 取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上 | 淀粉-KI试纸变蓝色 | 氯水中含有Cl2 |
| ④ | 将足量的氯水滴加到Na2CO3溶液中 | 出现气泡 | 氯水中含有H+ |
(2)指出实验②和实验④中的实验现象:②溶液褪色;④有气泡冒出.
(3)实验③中“实验方法”的具体操作过程是:取一小片KI淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①④实验无影响.
11.同温同压下,相同体积的任何气体中含有的分子数相同,在一定温度和压强下,50mL A2气体与75mL B2气体恰好化合生成50mL某气体化合物,则该化合物的化学式为( )
| A. | AB2 | B. | AB | C. | A3B | D. | A2B3 |
1.下列关于热化学反应的描述中正确的是( )
| A. | HCI和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ?mol-1 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
2.将下列各组中的每种有机物放入水中,振荡后再静置,液体分层且该组的全部物质都能浮在水的上层的是( )
| A. | 乙酸乙酯、甲苯、十一烷 | B. | 乙醇、苯、庚烯 | ||
| C. | 甘油、甲醛、硝基苯 | D. | 溴苯、四氯化碳、苯磺酸钠 |