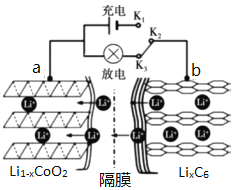
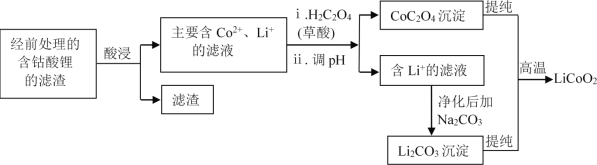
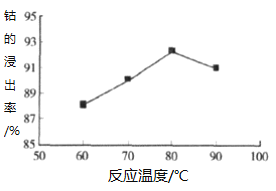
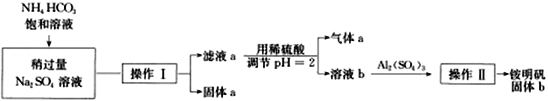
题目内容
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_____________________________,Cu位于元素周期表第ⅠB族。Cu 2+的核外电子排布式为____________________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O) 4 ]SO4 ·H2O,其结构示意图如下:
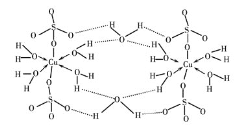
下列说法正确的是________(填字母)。
A.水中的氧原子采用sp3 杂化
B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1
D.胆矾中的水在不同温度下会分步失去
【答案】 [Ar]3d9 AD
[Ar]3d9 AD
【解析】
(1)[Cu(OH)4]2-配合物中,铜原子提供空轨道,OH-中氧原子提供孤电子对,Cu2+与4个OH-形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为: ;
;
Cu(电子排布式为:[Ar]3d104s1)Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子是为:[Ar]3d9或1s22s22p63s23p63d9;
(2)A.水中O原子为sp3杂化,硫酸根离子中羟基氧是sp3杂化,非羟基氧不是中心原子原子,不参与杂化杂化,选项A正确;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键,配离子与硫酸根之间形成离子键,选项B错误;
C.Cu2+的价电子排布式为[Ar]3d9或1s22s22p63s23p63d9,选项C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结构上有着不同,胆矾中的水在不同温度下会分步失去,选项D正确。
答案选AD。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:
![]()
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填上或下),分液后用____________(填入字母编号)洗涤。
a KMnO4溶液 b 稀H2SO4 c Na2CO3溶液
②再通过____________(填操作名称)即可得到精品。