题目内容
硫化钠是重要的工业原料。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
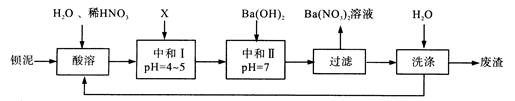
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。
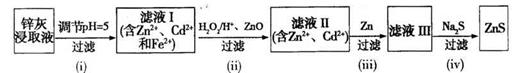
①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
(1)高温时,等物质的量甲烷与硫酸钠在催化剂作用下恰好完全反应,制得硫化钠。反应的化学方程式为__________________。
(2)甲同学往某Na2S样品(含Na2CO3、Na2SO4杂质)溶液中加人少量BaS溶液,产生白色沉淀,过滤,向滤渣中加人过量盐酸,沉淀完全溶解。由此得出结论:相同温度下,Ksp(BaCO3)<Ksp(BaSO4)。
①沉淀溶于盐酸的离子方程式是__________________。
②仅由上述实验无法判断Ksp(BaCO3)与Ksp(BaSO4)的大小关系,理由是______。
(3)利用Na2S为沉淀剂由锌灰可制得ZnS。锌灰经稀硫酸浸取后所得浸取液含Zn2+、Cd2+、Al3+、Fe2+, Fe3+等,由该浸取液制备ZnS的工艺流程如下图所示。

①步骤(i)所得滤渣中含有铝元素的物质为______(填化学式)。
②步骤(ii)所加ZnO的作用为____________。
③步骤(iii)中得到Cd单质的离子方程式为____________。
(15分)
(1)CH4+Na2SO4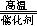 Na2S+CO2+2H2O(3分)
Na2S+CO2+2H2O(3分)
(2)BaCO3+2H+=Ba2++CO2↑+H2O(3分)
沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案)(2分)
(3)①Al(OH)3(2分)
②调节溶液的pH,使Fe3+形成Fe(OH)3沉淀(2分)
③Cd2++Zn=Cd+Zn2+(3分)
(1)CH4+Na2SO4
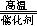 Na2S+CO2+2H2O(3分)
Na2S+CO2+2H2O(3分)(2)BaCO3+2H+=Ba2++CO2↑+H2O(3分)
沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案)(2分)
(3)①Al(OH)3(2分)
②调节溶液的pH,使Fe3+形成Fe(OH)3沉淀(2分)
③Cd2++Zn=Cd+Zn2+(3分)
试题分析:(1)、硫酸钠变为硫化钠时,硫元素由+6价降为—2价,由此推断甲烷中碳元素的化合价升高,由—4价升为+4价,生成CO2,根据最小公倍数法配平可得反应式CH4+Na2SO4
 Na2S+CO2+2H2O;(2)、Na2CO3、Na2SO4与BaS溶液均能反应生成白色的沉淀,但是BaCO3能溶于盐酸,反应式为BaCO3+2H+=Ba2++CO2↑+H2O,而BaSO4不溶于盐酸,但是不能说明Ksp(BaCO3)<Ksp(BaSO4),因为沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案);(3)、①pH=5时,Al3+几乎完全沉淀,则步骤(i)所得滤渣含有铝元素的物质为Al(OH)3;②步骤(ii)所加H2O2/H+的目的可以使Fe2+完全氧化为Fe3+,所加ZnO固体可以消耗溶液中的H+,减小H+浓度,使Fe3+彻底水解为Fe(OH)3沉淀,从而除铁;③步骤(iii)所加Zn能还原Cd2+,反应式为Cd2++Zn=Cd+Zn2+,从而除镉。
Na2S+CO2+2H2O;(2)、Na2CO3、Na2SO4与BaS溶液均能反应生成白色的沉淀,但是BaCO3能溶于盐酸,反应式为BaCO3+2H+=Ba2++CO2↑+H2O,而BaSO4不溶于盐酸,但是不能说明Ksp(BaCO3)<Ksp(BaSO4),因为沉淀的形成除了与Ksp有关外,还与溶液中沉淀组分的离子浓度大小有关(或其他合理答案);(3)、①pH=5时,Al3+几乎完全沉淀,则步骤(i)所得滤渣含有铝元素的物质为Al(OH)3;②步骤(ii)所加H2O2/H+的目的可以使Fe2+完全氧化为Fe3+,所加ZnO固体可以消耗溶液中的H+,减小H+浓度,使Fe3+彻底水解为Fe(OH)3沉淀,从而除铁;③步骤(iii)所加Zn能还原Cd2+,反应式为Cd2++Zn=Cd+Zn2+,从而除镉。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: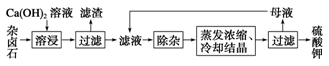

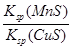
 Ca(OH)2(aq)
Ca(OH)2(aq)