题目内容
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s) 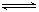 Ca(OH)2(aq)
Ca(OH)2(aq) 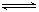 Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
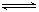 Ca(OH)2(aq)
Ca(OH)2(aq) 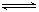 Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )| A.n(Ca2+)增大 | B.c(Ca2+)不变 | C.n(OH-)增大 | D.c(OH-)减小 |
B
试题分析:因为温度不变,则Ca(OH)2的溶解度不变,故c(Ca2+)不变。故选B。
点评:本题考查的是溶解平衡的应用和溶解度的相关知识,题目难度不大,注意对基础知识的学习、掌握及应用。

练习册系列答案
相关题目
 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
 2SO3△H<0
2SO3△H<0